
 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.请回答下列问题:
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.请回答下列问题:分析 (1)钠与水反应生成氢氧化钠与氢气,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(2)可燃性气体点燃前都必须验纯,否则容易发生爆炸;
(3)大块的钠与水反应剧烈,放出大量的热,容易产生危险事故;
(4)钠的密度比水的小,比苯的大,钠处于苯和水的交界处反应生成氢气,产生的H2使钠浮起,H2逸出,钠又回落水层.
解答 解:(1)钠与水反应生成氢氧化钠与氢气,反应离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Na+2H2O═2Na++2OH-+H2↑;2Al+2OH-+2H2O═2AlO2-+3H2↑;
(1)2Na+2H2O═2Na++2OH-+H2↑ 2Al+2OH-+2H2O═2AlO2-+3H2↑
(2)在点燃H2之前必须先进行检验H2的纯度,以免发生爆炸,
故答案为:检验H2的纯度;
(3)大块的钠与水反应剧烈,放出大量的热,可能使试管内H2和O2的混合气点燃而爆炸,
故答案为:大块的钠与水反应剧烈,放出大量的热,可能使试管内H2和O2的混合气点燃而爆炸;
(4)钠处于苯和水的交界处,钠与水反应产生的H2使钠浮起,跳离水面,反应停止,当钠表面的H2逸出,钠又回落水层,如此反复,钠间歇与水反应,
故答案为:钠处于苯和水的交界处,钠与水反应产生的H2使钠浮起,跳离水面,反应停止,当钠表面的H2逸出,钠又回落水层,如此反复,钠间歇与水反应.
点评 本题考查常见气体制备与性质实验、实验安全性问题,难度不大,注意渗透安全第一的意识.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 向NaHCO3溶液中加入足量的Ba(OH)2溶液2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O | |
| B. | 向石灰石中滴加稀硝酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 用惰性电极电解KOH溶液时阴极电极反应2H2O-4e-═O2+4H+ | |
| D. | NaOH溶液中通入少量硫化氢气体:2OH-+H2S═S2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑧ | B. | ③④⑤⑥⑧ | C. | ②④⑤⑥⑦ | D. | ①②④⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

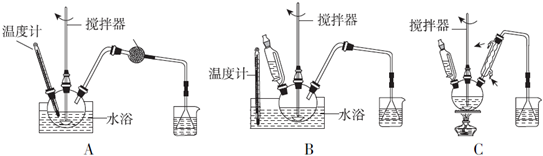
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原始社会人类学会利用火,他们以天然气取暖,吃熟食,从事生产活动 | |
| B. | 多年来我国广大农村生火做饭使用的都是化石燃料 | |
| C. | 多能源时代指的是新能源时代,包括核能、太阳能、氢能 | |
| D. | 化石燃料的燃烧没有污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
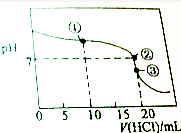 常温下,用0.1000mol•L-1的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,滴加20.00mL盐酸时所得溶液中,c(Cl-)=c(NH4+)+c(NH3•H2O)+c(NH3),下列说法错误的是( )
常温下,用0.1000mol•L-1的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,滴加20.00mL盐酸时所得溶液中,c(Cl-)=c(NH4+)+c(NH3•H2O)+c(NH3),下列说法错误的是( )| A. | 该氨水的浓度0.1000mol•L-1 | |
| B. | 点①溶液中c(NH4+)+c(NH3•H2O)+c(NH3)=2c(Cl-) | |
| C. | 点②溶液中c(NH4+)=c(Cl-) | |
| D. | 点③溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木炭和浓硫酸共热 | B. | 过氧化钠与足量的稀硫酸反应 | ||
| C. | 足量的铜与一定量的浓硝酸反应 | D. | 足量的锌和定量的浓硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
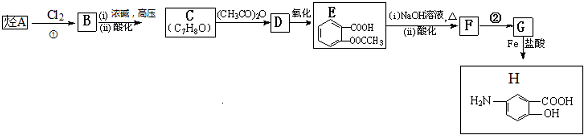
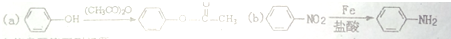
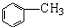 ,F含有的官能团是羧基和酚羟基(填名称).
,F含有的官能团是羧基和酚羟基(填名称).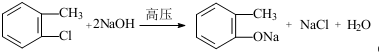 .
.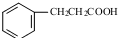 .
.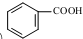 发生取代时,在羧基间位取代;②
发生取代时,在羧基间位取代;②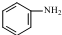 易发生氧化反应.以A为原料合成化合物
易发生氧化反应.以A为原料合成化合物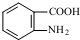 的设计合成路线为(其他试剂任选):
的设计合成路线为(其他试剂任选):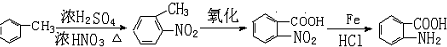 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com