
ЎҫМвДҝЎҝНкіЙПВБРМоҝХЈә
ЈЁ1Ј©ТСЦӘ·ҙУҰЈәFe2O3Ј«2Al![]() Al2O3Ј«2FeЈ¬Фт
Al2O3Ј«2FeЈ¬Фт
ўЩёГ·ҙУҰЛщКф»щұҫ·ҙУҰАаРНКЗ___ЎЈ
ўЪФЪ·ҙУҰЦРМъФӘЛШөД»ҜәПјЫұд»Ҝ__(МоЎ°ЙэёЯЎұ»тЎ°ҪөөНЎұ)Ј¬ёГФӘЛШөДФӯЧУ__(МоЎ°К§ИҘЎұ»тЎ°өГөҪЎұ)өзЧУЎЈ
ўЫ·ўЙъСх»Ҝ·ҙУҰөДКЗ__Ј¬·ўЙъ»№Фӯ·ҙУҰөДКЗ__ЎЈ
ЈЁ2Ј©·ҙУҰ2KMnO4Ј«16HCl(ЕЁ)=2MnCl2Ј«2KClЈ«5Cl2ЎьЈ«8H2OЦРЈә
ўЩ·ҙУҰЦРұ»Сх»ҜөДФӘЛШКЗ__Ј¬ұ»»№ФӯөДФӘЛШКЗ___ЎЈ
ўЪИфЙъіЙ71gCl2Ј¬ФтПыәДөДHClКЗ__gЈ¬ұ»Сх»ҜөДHClКЗ__gЎЈ
Ўҫҙр°ёЎҝЦГ»»·ҙУҰ ҪөөН өГөҪ Al Fe2O3 Cl Mn 116.8 73
ЎҫҪвОцЎҝ
(1)ўЩ·ҙУҰ·ыәП»щұҫ·ҙУҰАаРНөДAB+C=AC+BЎЈ
ўЪ·ҙУҰЦРЈ¬FeөД»ҜәПјЫУЙ+3јЫұдОӘ0јЫЈ»
ўЫ·ҙУҰЦРЈ¬»№ФӯјБұ»Сх»ҜЈ¬·ўЙъСх»Ҝ·ҙУҰЎЈ
(2)ўЩ»№ФӯјБұ»Сх»ҜЈ¬Сх»ҜјБұ»»№ФӯЈ»
ўЪёщҫЭ·ҪіМКҪҪшРРјЖЛгЎЈ
(1)ўЩ·ҙУҰ·ыәП»щұҫ·ҙУҰАаРНөДAB+C=AC+BЈ¬КфУЪЦГ»»·ҙУҰЎЈ
ўЪ·ҙУҰЦРЈ¬FeөД»ҜәПјЫУЙ+3јЫұдОӘ0јЫЈ¬»ҜәПјЫҪөөНЈ¬өГөзЧУЈ»
ўЫ·ҙУҰЦРЈ¬»№ФӯјБұ»Сх»ҜЈ¬·ўЙъСх»Ҝ·ҙУҰЈ¬ФтAl·ўЙъСх»Ҝ·ҙУҰЈ»Fe2O3·ўЙъ»№Фӯ·ҙУҰЎЈ
(2)ўЩ»№ФӯјБұ»Сх»ҜЈ¬Сх»ҜјБұ»»№ФӯЈ¬ФтClұ»Сх»ҜЈ¬Mnұ»»№ФӯЈ»
ўЪИфЙъіЙ71gCl2Ј¬јҙ1molЈ¬РиПыәД3.2molHClЈ¬јҙ3.2ЎБ36.5=116.8gЈ»»ҜәПјЫЙэёЯөДHClОӘ2molЈ¬јҙ73gЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРЛө·ЁХэИ·өДКЗЈЁЎЎЎЎЈ©
A.ТСЦӘXФЪТ»¶ЁМхјюПВЧӘ»ҜОӘY, ,XУлY»ҘОӘН¬ПөОп,ҝЙУГ
,XУлY»ҘОӘН¬ПөОп,ҝЙУГ![]() ИЬТәјшұр
ИЬТәјшұр
B.![]() ДЬ·ўЙъөД·ҙУҰАаРНУРЈәјУіЙ·ҙУҰЎўИЎҙъ·ҙУҰЎўПыИҘ·ҙУҰЎўСх»Ҝ·ҙУҰ
ДЬ·ўЙъөД·ҙУҰАаРНУРЈәјУіЙ·ҙУҰЎўИЎҙъ·ҙУҰЎўПыИҘ·ҙУҰЎўСх»Ҝ·ҙУҰ
C.![]() јЧ»щ
јЧ»щ![]() ТТ»щОмНйөДТ»ВИИЎҙъІъОпУР5ЦЦ
ТТ»щОмНйөДТ»ВИИЎҙъІъОпУР5ЦЦ
D.ПаН¬МхјюПВТТЛбТТхҘФЪЛ®ЦРөДИЬҪв¶ИұИФЪТТҙјЦРөДИЬҪв¶ИТӘҙу
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ·ҙУҰC2H6(g)![]() C2H4(g)+H2(g) ЎчH>0Ј¬ФЪТ»¶ЁМхјюПВУЪГЬұХИЭЖчЦРҙпөҪЖҪәвЎЈПВБРёчПоҙлК©ЦРЈ¬І»ДЬМбёЯТТНйЖҪәвЧӘ»ҜВКөДКЗ( )
C2H4(g)+H2(g) ЎчH>0Ј¬ФЪТ»¶ЁМхјюПВУЪГЬұХИЭЖчЦРҙпөҪЖҪәвЎЈПВБРёчПоҙлК©ЦРЈ¬І»ДЬМбёЯТТНйЖҪәвЧӘ»ҜВКөДКЗ( )
A. ФцҙуИЭЖчИЭ»эB. ЙэёЯ·ҙУҰОВ¶И
C. ·ЦАліцІҝ·ЦЗвЖшD. өИИЭПВНЁИл¶иРФЖшМе
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ¶ФУЪҝЙДж·ҙУҰЈә2A(g)+B(g)![]() 2C(g) ҰӨH <0Ј¬ПВБРёчНјЦРХэИ·өДКЗЈЁ Ј©
2C(g) ҰӨH <0Ј¬ПВБРёчНјЦРХэИ·өДКЗЈЁ Ј©
A. B.
B.
C.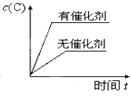 D.
D.
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіОВ¶ИПВЈ¬өұ1 g°ұЖшНкИ«·ЦҪвОӘөӘЖшЎўЗвЖшКұЈ¬ОьКХ2.72 kJөДИИБҝЈ¬ФтҙЛЧҙМ¬ПВЈ¬ПВБРИИ»ҜС§·ҪіМКҪХэИ·өДКЗ (ЎЎЎЎ)
ўЩN2(g)Ј«3H2(g) = 2NH3(g)ЎЎҰӨHЈҪЈӯ92.4 kJ/mol
ўЪN2(g)Ј«3H2(g) = 2NH3(g)ЎЎҰӨHЈҪЈӯ46.2 kJ/mol
ўЫNH3(g) =![]() N2(g)Ј«
N2(g)Ј«![]() H2(g)ЎЎҰӨHЈҪЈ«46.2 kJ/mol
H2(g)ЎЎҰӨHЈҪЈ«46.2 kJ/mol
ўЬ2NH3(g) = N2(g)Ј«3H2(g)ЎЎҰӨHЈҪЈӯ92.4 kJ/mol
A.ўЩўЪB.ўЩўЫC.ўЩўЪўЫD.И«Іҝ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЖыіөОІЖшЦРә¬УРCOЎўNOxөИУР¶ҫЖшМеЈ¬¶ФЖыіөјУЧ°ОІЖшҫ»»ҜЧ°ЦГЈ¬ҝЙК№УР¶ҫЖшМеПа»Ҙ·ҙУҰЧӘ»ҜОӘОЮ¶ҫЖшМеЎЈ
ЈЁ1Ј©ТСЦӘ 4CO(g)Ј«2NO2(g)![]() 4CO2(g)Ј«N2(g) ҰӨH= -1200kJЎӨmol-1
4CO2(g)Ј«N2(g) ҰӨH= -1200kJЎӨmol-1
ўЩёГ·ҙУҰФЪ________________ЈЁМоЎ°ёЯОВЎўөНОВ»тИОәООВ¶ИЎұЈ©ПВДЬЧФ·ўҪшРРЎЈ
ўЪ¶ФУЪёГ·ҙУҰЈ¬ёДұдДіТ»·ҙУҰМхјюЈЁОВ¶ИT1>T2Ј©Ј¬ПВБРНјПсХэИ·өДКЗ_______(МоРтәЕ)ЎЈ
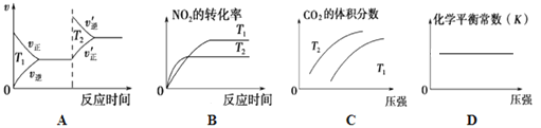
ўЫДіКөСйРЎЧйДЈДвЙПКцҫ»»Ҝ№эіМЈ¬Т»¶ЁОВ¶ИПВЈ¬ФЪ 2LөДәгИЭГЬұХИЭЖчЦРЈ¬ЖрКјКұ°ҙХХјЧЎўТТБҪЦЦ·ҪКҪҪшРРН¶БПЈ¬ҫӯ№эТ»¶ОКұјдәуҙпөҪЖҪәвЧҙМ¬Ј¬ІвөГјЧЦРCOөДЧӘ»ҜВКОӘ50%Ј¬ФтёГ·ҙУҰөДЖҪәвіЈКэОӘ__________Ј»БҪЦЦ·ҪКҪҙпЖҪәвКұЈ¬N2өДМе»э·ЦКэЈәјЧ______ТТЈЁ МоЎ°>Ўў=Ўў<»тІ»И·¶ЁЎұЈ¬ПВН¬Ј©Ј¬NO2өДЕЁ¶ИЈәјЧ______ТТЎЈ
јЧ | ТТ |
0.2mol NO2 | 0.1mol NO2 |
0.4mol CO | 0.2mol CO |
ЈЁ2Ј©ІсУНЖыіөОІЖшЦРөДМјСМ(C)әНNOxҝЙНЁ№эДіә¬оЬҙЯ»ҜјБҙЯ»ҜПыіэЎЈІ»Н¬ОВ¶ИПВЈ¬Ҫ«ДЈДвОІЖшЈЁіЙ·ЦИзПВұнЛщКҫЈ©ТФПаН¬өДБчЛЩНЁ№эёГҙЯ»ҜјБІвөГЛщУРІъОп(CO2ЎўN2ЎўN2O)УлNOөДПа№ШКэҫЭҪб№ыИзНјЛщКҫЎЈ
ДЈДвОІЖш | ЖшМеЈЁ10molЈ© | МјСМ | ||
NO | O2 | He | ||
ОпЦКөДБҝЈЁmolЈ© | 0.025 | 0.5 | 9.475 | a |
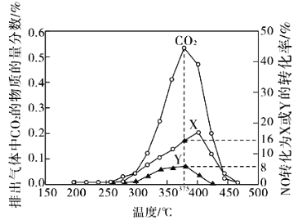
ўЩ375ЎжКұЈ¬ІвөГЕЕіцөДЖшМеЦРә¬0.45mol O2әН0.0525mol CO2Ј¬ФтYөД»ҜС§КҪОӘ________ЎЈ
ўЪКөСй№эіМЦРІЙУГNOДЈДвNOxЈ¬¶шІ»ІЙУГNO2өДФӯТтКЗ______________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝCO2әНCH4ҙЯ»ҜЦШХыҝЙЦЖұёәПіЙЖшЈ¬¶Фјх»әИјБПОЈ»ъҫЯУРЦШТӘөДТвТеЈ¬Жд·ҙУҰАъіМКҫТвНјИзПВЈә

ПВБРЛө·ЁІ»ХэИ·өДКЗ
A. әПіЙЖшөДЦчТӘіЙ·ЦОӘCOәНH2
B. ўЩЎъўЪјИУРМјСхјьөД¶ПБСЈ¬УЦУРМјСхјьөДРОіЙ
C. ўЩЎъўЪОьКХДЬБҝ
D. NiФЪёГ·ҙУҰЦРЧцҙЯ»ҜјБ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ¶ФПВБР№эіМөД»ҜС§УГУпұнКцХэИ·өДКЗ
A. УГБтЛбНӯИЬТәіэИҘТТИІЦРөДБт»ҜЗвЖшМеЈәH2S + Cu2+=== CuSЎэ + 2H+
B. ПтВИ»ҜВБИЬТәЦРөОИл№эБҝ°ұЛ®ЈәAl3+ + 4OH- === AlO2- + 2H2O
C. УГөзЧУКҪұнКҫNaәНClРОіЙNaClөД№эіМЈә![]()
D. ёЦМъ·ўЙъөз»ҜС§ёҜКҙөДХэј«·ҙУҰЈәFe-3e- === Fe3+
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝҪ«Т»¶ЁЦКБҝөДГҫВБ·ЫД©»мәПОпН¶ИлТ»¶ЁЕЁ¶ИөД200 mLСОЛбЦР,К№әПҪрИ«ІҝИЬҪв,ПтЛщөГИЬТәЦРөОјУ5.0 molЎӨL-1өДNaOHИЬТәЦБ№эБҝ,ЙъіЙіБөнөДЦКБҝУлјУИлNaOHИЬТәөДМе»эөД№ШПөИзНјЛщКҫЎЈ
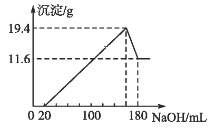
(1)ФӯәПҪрЦРВБөДОпЦКөДБҝ·ЦКэОӘ_____________ЎЈ
(2)СОЛбЦРHClөДОпЦКөДБҝЕЁ¶ИОӘ_____________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com