
【题目】对于可逆反应:2A(g)+B(g)![]() 2C(g) ΔH <0,下列各图中正确的是( )
2C(g) ΔH <0,下列各图中正确的是( )
A. B.
B.
C.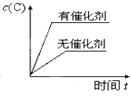 D.
D.
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:
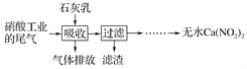
(1)一定条件下,NO与NO2可以生成一种新的氧化物,试写出该反应的化学方程式:___。
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是__;滤渣可循环使用,滤渣的主要成分是__(填化学式)。
(3)该工艺需控制NO和NO2物质的量之比接近1∶1。
若n(NO)∶n(NO2)>1∶1,则会导致__;
若n(NO)∶n(NO2)<1∶1,则会导致__。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中,甲由C、H、O三种元素组成,元素的质量比为12:3:8,甲的沸点为78.5℃,其蒸气与H2的相对密度是23。将温度控制在400℃以下,按要求完成实验。

(1)在通入空气的条件下进行实验,加入药品后的操作依次是___。(填序号)
a.打开活塞
b.用鼓气气球不断鼓入空气
c.点燃酒精灯给铜丝加热
(2)实验结束,取试管中的溶液与新制的Cu(OH)2混合,加热至沸腾,实验现象为___。
(3)现用10%的NaOH溶液和2%的CuSO4溶液,制取本实验所用试剂Cu(OH)2,请简述实验操作___。。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
①CH3—CH=CH2和CH2=CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2 L的庚烷所含的分子数为0.5NA(NA为阿伏加德罗常数)
⑥能够快速、微量、精确地测定相对分子质量的物理方法是核磁共振谱法
A.①⑤⑥B.②③④C.③⑤⑥D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列有机化合物的结构简式,完成填空。
①CH3CH2CH2CH2CH3②C2H5OH③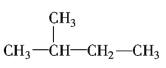 ④
④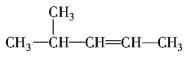 ⑤
⑤![]() ⑥
⑥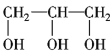 ⑦
⑦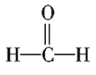 ⑧
⑧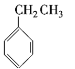 ⑨
⑨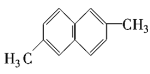 ⑩
⑩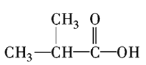
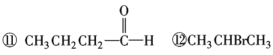
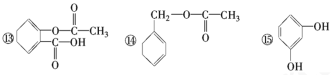
请你对以上有机化合物进行分类,其中,
属于烷烃的是________;属于烯烃的是________;
属于芳香烃的是________;属于卤代烃的是________;
属于醇的是________;属于醛的是________;
属于羧酸的是________;属于酯的是________;
属于酚的是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业上使用的印刷电路板,是在敷有铜膜的塑料板上以涂层保护所要的线路,然后用三氯化铁浓溶液作用掉(腐蚀)未受保护的铜膜后形成的。某工程师为了从使用过的腐蚀废液(含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用下列步骤:
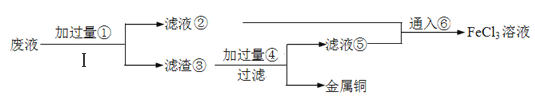
(1)步骤Ⅰ的操作名称:________;所需玻璃仪器:_________、_________、__________。
(2)写出FeCl3溶液与铜箔发生反应的离子方程式:______________________。
(3)检验废腐蚀液中是否含有Fe3+所需试剂名称:___________、实验现象:__________。
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:________________,此转化的化学方程式为:______________________________。
(5)写出③中所含物质:_________⑥发生反应的离子方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空:
(1)已知反应:Fe2O3+2Al![]() Al2O3+2Fe,则
Al2O3+2Fe,则
①该反应所属基本反应类型是___。
②在反应中铁元素的化合价变化__(填“升高”或“降低”),该元素的原子__(填“失去”或“得到”)电子。
③发生氧化反应的是__,发生还原反应的是__。
(2)反应2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O中:
①反应中被氧化的元素是__,被还原的元素是___。
②若生成71gCl2,则消耗的HCl是__g,被氧化的HCl是__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备合成气的工艺主要是水蒸气重整甲烷: CH4(g)+H2O(g)CO(g)+3H2(g) ΔH>0,在一定条件下,向体积为1L的密闭容器中充入1 molCH4(g)和1molH2O(g),测得 H2O(g)和 H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是 ( )
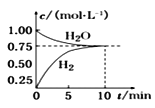
A.达到平衡时,CH4(g)的转化率为75%
B.0~10 min内,v(CO)=0.075 mol·L-1·min -1
C.该反应的化学平衡常数K=0.1875
D.当CH4(g)的消耗速率与H2(g)的消耗速率相等时,反应到达平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弾的工作电源。一种热激活电池的基本结钩如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,此时硫酸铅电极处生成Pb,下列有关说法正确的是( )

A. 输出电能时,外电路中的电子由硫酸铅电极流向钙电极
B. 放电时电解质LiCl-KCl中的Li+向钙电极区迁移
C. 每转0.2mol电子,论上消耗42.5gLiCl
D. 电池总反应为Ca+PbSO4+2LiCl=Pb+Li2SO4+CaCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com