
【题目】利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:
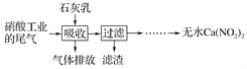
(1)一定条件下,NO与NO2可以生成一种新的氧化物,试写出该反应的化学方程式:___。
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是__;滤渣可循环使用,滤渣的主要成分是__(填化学式)。
(3)该工艺需控制NO和NO2物质的量之比接近1∶1。
若n(NO)∶n(NO2)>1∶1,则会导致__;
若n(NO)∶n(NO2)<1∶1,则会导致__。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为__。
【答案】NO+NO2![]() N2O3 使尾气中的NO、NO2被充分吸收 Ca(OH)2 排放气体中NO含量升高 产品Ca(NO2)2中Ca(NO3)2含量升高 3NO2-+2H+=NO3-+2NO↑+H2O
N2O3 使尾气中的NO、NO2被充分吸收 Ca(OH)2 排放气体中NO含量升高 产品Ca(NO2)2中Ca(NO3)2含量升高 3NO2-+2H+=NO3-+2NO↑+H2O
【解析】
由流程可知,石灰乳和硝酸工业的尾气(含NO、NO2)反应,生成Ca(NO2)2,过量的石灰乳以滤渣存在,滤液为Ca(NO2)2溶液,经过一系列处理得到无水Ca(NO2)2。结合氮的氧化物的性质分析解答。
(1)若NO与NO2反应生成新的氧化物,必然是NO中N的化合价升高被氧化,NO2中N的化合价降低被还原,生成的新的氧化物中N的化合价应该介于+2和+4之间,为+3价,反应的化学方程式为NO+NO2![]() N2O3,故答案为:NO+NO2
N2O3,故答案为:NO+NO2![]() N2O3;
N2O3;
(2)气体上升液体下降,这样气液接触充分,使尾气中NO、NO2与石灰乳充分接触,NO、NO2被充分吸收;根据加入的原料及生成物,只有Ca(OH)2微溶于水,所以滤渣的主要成分为Ca(OH)2,故答案为:使尾气中NO、NO2被充分吸收;Ca(OH)2;
(3)若n(NO)∶n(NO2)>1∶1,则一氧化氮过量,排放气体中NO含量升高;若n(NO)∶n(NO2)<1∶1,则二氧化氮过量,二氧化氮可与石灰乳反应生成Ca(NO3)2,故答案为:排放气体中NO含量升高;产品Ca(NO2)2中Ca(NO3)2含量升高;
(4)依据化合价升降守恒,NO2-生成NO时氮元素化合价降低,则反应中一部分NO2-中氮元素的化合价一定升高,可能生成NO3-或NO2,但在水溶液中NO2会与水反应生成NO3-,所以最终产物为NO3-,即反应物是NO2-和H+,生成物是一氧化氮,硝酸根和水,反应的离子方程式为3NO2-+2H+=NO3-+2NO↑+H2O,故答案为:3NO2-+2H+=NO3-+2NO↑+H2O。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)。
CO2(g)+4H2(g)。
已知下列键能数据:
化学键 | C—H | H—O | C=O | H—H |
键能/kJ·mol-1 | 414 | 464 | 803 | 436 |
则该反应的△H=( )
A.+162kJ·mol-1B.-766kJ·mol-1C.-162kJ·mol-1D.+1470kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示:

请你根据上图推断:
(1)原溶液中一定存在的阴离子有_______________,显___(填“酸”“碱”或“中”)性。
(2)实验③中产生无色无味气体所发生的化学方程式为__________________________________。
(3)写出实验④中A点对应沉淀的化学式:__________。
(4)写出实验④中,由A→B过程中所发生反应的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )
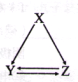
选项 | X | Y | Z |
A | AlCl3 | Al(OH)3 | NaAlO2 |
B | C | CO | CO2 |
C | CH2=CH2 | CH3CH2Br | CH3CH2OH |
D | S | SO2 | SO3 |
A.AB.BC..CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体,下列说法正确的是 ( )
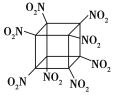
A. 分子中C、N间形成非极性键B. 1 mol该分子中含8 mol二氧化氮
C. 该物质既有氧化性又有还原性D. 该物质爆炸产物是NO2、CO2、H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。[配制酸性KMnO4标准溶液]如图是配制50mL酸性KMnO4标准溶液的过程示意图。
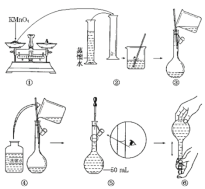
(1)请你观察图示判断其中不正确的操作有________(填序号)。
(2)其中确定50mL溶液体积的容器是__________________________________(填名称)。
(3)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测得的实验结果将______(填“偏大”或“偏小”)。
[测定血液样品中Ca2+的浓度]抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol·L-1酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL酸性KMnO4溶液。
(4)已知草酸与酸性KMnO4溶液反应的离子方程式为:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O滴定时,根据现象_______________________________________,即可确定反应达到终点。
(5)经过计算,血液样品中Ca2+的浓度为________mg·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.已知X在一定条件下转化为Y,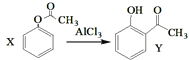 ,X与Y互为同系物,可用
,X与Y互为同系物,可用![]() 溶液鉴别
溶液鉴别
B.![]() 能发生的反应类型有:加成反应、取代反应、消去反应、氧化反应
能发生的反应类型有:加成反应、取代反应、消去反应、氧化反应
C.![]() 甲基
甲基![]() 乙基戊烷的一氯取代产物有5种
乙基戊烷的一氯取代产物有5种
D.相同条件下乙酸乙酯在水中的溶解度比在乙醇中的溶解度要大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”(结构式中用“*”加以标注)。凡有一个手性碳原子的物质一定具有光学活性。物质: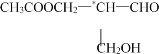 有光学活性,当它发生下列反应后生成的有机物中仍有光学活性的是( )
有光学活性,当它发生下列反应后生成的有机物中仍有光学活性的是( )
A.与乙酸发生酯化反应
B.与NaOH水溶液共热
C.在催化剂存在下与H2反应
D.与新制的Cu(OH)2悬浊液共热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com