
【题目】人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。[配制酸性KMnO4标准溶液]如图是配制50mL酸性KMnO4标准溶液的过程示意图。
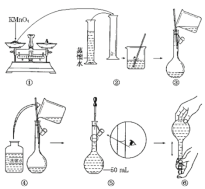
(1)请你观察图示判断其中不正确的操作有________(填序号)。
(2)其中确定50mL溶液体积的容器是__________________________________(填名称)。
(3)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测得的实验结果将______(填“偏大”或“偏小”)。
[测定血液样品中Ca2+的浓度]抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol·L-1酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL酸性KMnO4溶液。
(4)已知草酸与酸性KMnO4溶液反应的离子方程式为:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O滴定时,根据现象_______________________________________,即可确定反应达到终点。
(5)经过计算,血液样品中Ca2+的浓度为________mg·cm-3。
【答案】②⑤ 50mL容量瓶 偏小 溶液由无色变为紫红色,且半分钟内不褪色 1.2
【解析】
(1)根据配制一定物质的量浓度的溶液的正确操作结合图示分析解答;
(2)容量瓶是确定溶液体积的仪器;
(3)依据仰视刻度线,会使溶液体积偏大判断,结合![]() 分析;
分析;
(4)草酸跟酸性KMnO4溶液反应生成二氧化碳、二价锰离子等,滴定时,用高锰酸钾滴定草酸,反应达到终点时,滴入的高锰酸钾溶液不褪色,据此判断;
(5)根据滴定数据及钙离子与高锰酸钾的关系式计算出血液样品中Ca2+的浓度。
(1)由图示可知②⑤操作不正确,②不能在量筒中溶解固体,⑤定容时应平视刻度线,至溶液凹液面与刻度线相切,故答案为:②⑤;
(2)应该用容量瓶准确确定50mL溶液的体积,故答案为:50mL容量瓶;
(3)如果用图示的操作配制溶液,由于仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小,故答案为:偏小;
(4)滴定时,用高锰酸钾滴定草酸,反应达到终点时的现象为溶液由无色变为紫红色,且半分钟内不褪色,故答案为:溶液由无色变为紫红色,且半分钟内不褪色;
(5)血样20.00mL经过上述处理后得到草酸,草酸消耗的消耗的高锰酸钾的物质的量为:![]() 。根据反应方程式
。根据反应方程式![]() ,及草酸钙的化学式CaC2O4,可知:
,及草酸钙的化学式CaC2O4,可知:![]() ,Ca2+的质量为
,Ca2+的质量为![]() ,钙离子的浓度为:
,钙离子的浓度为:![]() ,故答案为:1.2。
,故答案为:1.2。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是
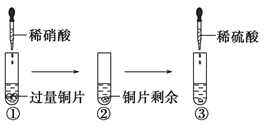
A.实验①中试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B.实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C.由上述实验可得出结论:Cu在常温下既可以与稀硝酸反应,也可以与稀硫酸反应
D.实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4 =4CuSO4+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产生活中有重要的作用。请回答下列问题:
(1)肼(N2H4)通常用作火箭的高能燃料,工业上常用次氯酸钠(NaClO)与过量的氨气反应制备肼,该反应的化学方程式为___;
(2)N2(g)+3H2(g)![]() 2NH3(g)为放热反应。800K时向下列起始体积相同的密闭容器中充入2molN2、3molH2,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器为绝热恒容容器,三容器各自建立化学平衡。
2NH3(g)为放热反应。800K时向下列起始体积相同的密闭容器中充入2molN2、3molH2,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器为绝热恒容容器,三容器各自建立化学平衡。
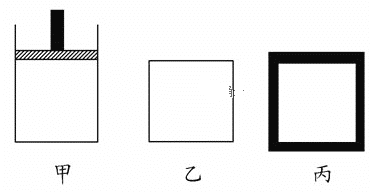
①达到平衡状态时,平衡常数K甲___K乙(填“>”、“<”或“=”);
②达到平衡状态时,N2的浓度c乙(N2)___c丙(N2);
(3)100kPa时,反应2NO(g)+O2(g)![]() 2NO2(g)中的NO的平衡转化率与温度的关系曲线如图1所示,反应2NO2(g)
2NO2(g)中的NO的平衡转化率与温度的关系曲线如图1所示,反应2NO2(g)![]() N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2所示。
N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2所示。
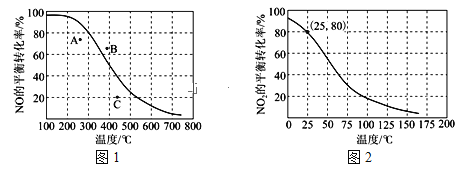
①图1中A、B、C三点表示不同温度、不同压强下2NO(g)+O2(g)![]() 2NO2(g)达到平衡时NO的转化率,则___点对应的压强最大;
2NO2(g)达到平衡时NO的转化率,则___点对应的压强最大;
②对于反应2NO2(g)![]() N2O4(g),写出用平衡分压代替平衡浓度计算平衡常数的表达式Kp=___;依据图2,计算100kPa,25℃时,Kp=___(写清数值和单位)。
N2O4(g),写出用平衡分压代替平衡浓度计算平衡常数的表达式Kp=___;依据图2,计算100kPa,25℃时,Kp=___(写清数值和单位)。
(分压计算:某物质X的分压:P(X)=总压×X的物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为金属单质,B、C、D、E 四种均为含有氯元素的物质,它们存在如图转化关系(部分产物已略去,有的反应在溶液中进行)。请回答:

(1)A 是_____________,C 是_____________。(均用化学式表示)
(2)写出实验室制备 D 的化学方程式:_____________。
(3)写出用 B 溶液与 Cu 反应制作印刷电路板的离子方程式:_____________。
(4)设计实验方案,检验 C 溶液中的金属阳离子:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:
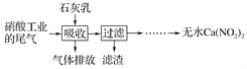
(1)一定条件下,NO与NO2可以生成一种新的氧化物,试写出该反应的化学方程式:___。
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是__;滤渣可循环使用,滤渣的主要成分是__(填化学式)。
(3)该工艺需控制NO和NO2物质的量之比接近1∶1。
若n(NO)∶n(NO2)>1∶1,则会导致__;
若n(NO)∶n(NO2)<1∶1,则会导致__。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X和Y可作为“分子伞”,用于药载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)
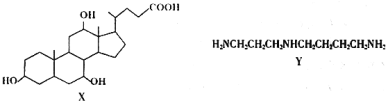
下列叙述错误的是( )
A.X的分子式为![]()
B.1mol X在浓硫酸作用下发生消去反应,最多生成3 mol ![]()
C.X与HBr的反应为消去反应
D.Y和癸烷的分子链均呈锯齿形,但Y的极性较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.用系统命名法命名有机物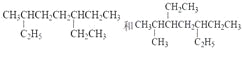 ,主链碳原子数均为7 个
,主链碳原子数均为7 个
B.![]() 能使KMnO4溶液褪色,说明苯环与甲基相连的碳碳单键变得活泼,被KMnO4氧化而断裂
能使KMnO4溶液褪色,说明苯环与甲基相连的碳碳单键变得活泼,被KMnO4氧化而断裂
C.蛋白质和油脂都属于高分子化合物,一定条件下能水解
D.1mol 绿原酸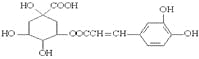 通过消去反应脱去1 molH2O时,能得到6 种不同产物(不考虑立体异构)
通过消去反应脱去1 molH2O时,能得到6 种不同产物(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是化学实验室中最常见的有机物,其产量可以用来衡量一个国家的石油化工发展水平,还是一种植物生长调节剂。A和HCl反应生成B,B与烧碱溶液生成C,C氧化D,D能发生银镜反应,D氧化成E,C和E生成具有果香味的化合物F,请写出有关反应方程式,并在( )中写明反应类型
(1)A→B:___,(________);
(2)C→D:___,(________);
(3)D与新制Cu(OH)2反应:___,(_______);
(4)C+E→F:___,(________)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业上使用的印刷电路板,是在敷有铜膜的塑料板上以涂层保护所要的线路,然后用三氯化铁浓溶液作用掉(腐蚀)未受保护的铜膜后形成的。某工程师为了从使用过的腐蚀废液(含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用下列步骤:
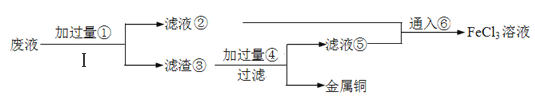
(1)步骤Ⅰ的操作名称:________;所需玻璃仪器:_________、_________、__________。
(2)写出FeCl3溶液与铜箔发生反应的离子方程式:______________________。
(3)检验废腐蚀液中是否含有Fe3+所需试剂名称:___________、实验现象:__________。
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:________________,此转化的化学方程式为:______________________________。
(5)写出③中所含物质:_________⑥发生反应的离子方程式:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com