
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是
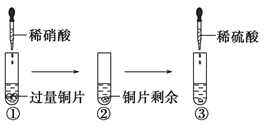
A.实验①中试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B.实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C.由上述实验可得出结论:Cu在常温下既可以与稀硝酸反应,也可以与稀硫酸反应
D.实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4 =4CuSO4+2NO↑+4H2O
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O42H2O,M=180g/mol)呈淡黄色,可用作晒制蓝图。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究
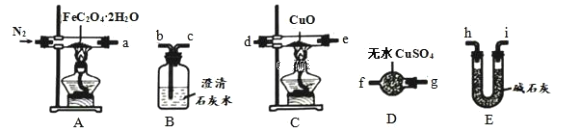
(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:
①按照气流从左到右的方向,上述装置的接口顺序为 a→g→f→___________→尾气处理装置(仪器可重复使用)。
②实验前先通入一段时间 N2,其目的为__________。
③实验证明了气体产物中含有 CO,依据的实验现象为__________。
(2)小组成员设计实验证明了 A 中分解后的固体成分为 FeO,则草酸亚铁晶体分解的化学方程式为__________。
(3)晒制蓝图时,以 K3[Fe(CN)6]溶液为显色剂,该反应的化学方程式为__________。
Ⅱ.草酸亚铁晶体样品纯度的测定:工业制得的草酸亚铁晶体中常含有 FeSO4 杂质,测定其纯度的步骤如下:
步骤 1:称取 mg 草酸亚铁晶体样品并溶于稀 HSO4 中,配成 250mL 溶液;
步骤 2:取上述溶液 25.00mL,用 cmol/L KMnO4 标准液滴定至终点,消耗标准液 V1mL;
步骤 3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀 H2SO4,再用 cmol/L KMnO4 标准溶液滴定至终点,消耗标准液 V2mL。
(4)步骤 2 中滴定终点的现象为__________;步骤 3 中加入锌粉的目的为__________。
(5)草酸亚铁晶体样品的纯度为__________;若步骤 1配制溶液时部分Fe2+被氧化变质,则测定结果将__________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的电子式为·![]() ·,B原子L层的电子总数是K层的3倍,0.1 mol C单质能从酸中置换出2.24 L(标准状况)氢气,同时它的电子层结构变成与氖原子相同的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
·,B原子L层的电子总数是K层的3倍,0.1 mol C单质能从酸中置换出2.24 L(标准状况)氢气,同时它的电子层结构变成与氖原子相同的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
(1)写出A、B、C、D元素的名称:A________,B______,C________,D________。
(2)D元素在周期表中属于第________周期______族。
(3)用电子式表示A的气态氢化物的形成过程:____________。
(4)A和B的单质充分反应生成的化合物的结构式是___________。
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明?_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200mL 1molL—1的氯化铝溶液中加入一定体积的2molL—1的NaOH溶液,最终产生7.8g沉淀,则加入的NaOH溶液的体积可能为
①350mL ②90mL ③150mL ④200mL
A. 只有① B. ①③ C. ②④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)。
CO2(g)+4H2(g)。
已知下列键能数据:
化学键 | C—H | H—O | C=O | H—H |
键能/kJ·mol-1 | 414 | 464 | 803 | 436 |
则该反应的△H=( )
A.+162kJ·mol-1B.-766kJ·mol-1C.-162kJ·mol-1D.+1470kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中,A为一种中学化学中常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色实验均为黄色。
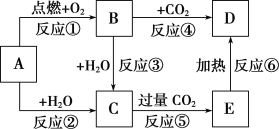
(1)写出下列物质的化学式:B___。
(2)以上6个反应中属于氧化还原反应的有___(填写编号)。
(3)写出A →C反应的离子方程式___。
(4)写出B→C反应的离子方程式:___;E→D的化学方程式:___。
(5)加热5.00gD和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31g,则原混合物中D的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯为主要原料,制取高分子材料N和R的流程如下:
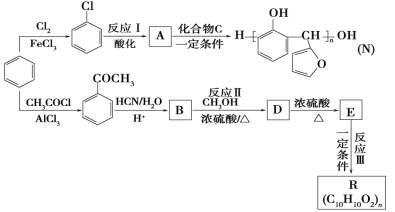
已知: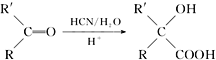
(1)B中含氧官能团的名称是___。
(2)由![]() 生成
生成![]() 的反应类型是___。
的反应类型是___。
(3)一定条件下,发生反应Ⅰ所需的其他反应试剂是_____。
(4)化合物C的结构简式是_____。
(5)反应Ⅱ的化学反应方程式是_____。
(6)下列说法正确的是____ (填字母)。
a.A可与NaOH溶液反应
b.常温下,A能和水以任意比混溶
c.化合物C可使酸性高锰酸钾溶液褪色
d.E存在顺反异构体
(7)反应Ⅲ的化学反应方程式是_____。
(8)符合下列条件的B的同分异构体有______种。
a.能与饱和溴水反应生成白色沉淀 b.属于酯类 c.苯环上只有两个对位取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大。①A元素组成的单质是相同条件下密度最小的物质;②B元素原子的最外层电子数是其内层电子总数的2倍;③D原子的电子层数与最外层电子数之比为3:1;④E元素的最外层电子数是电子层数的2倍;⑤C与E同主族。请回答下列问题:
(1)B元素在周期表中的位置是:______________
(2)写出化合物D2C2的电子式____________;该化合物中所含化学键类型为____________
(3)化合物A2C和A2E中,沸点较高的是______________(填化学式)
(4)化合物EC2常温下呈气态,将其通入Ba(NO3)2溶液中,有白色沉淀和NO气体放出,该反应的离子方程式为_______________
(5)元素A、B、C按原子个数比2:1:1组成的化合物是常见的室内装修污染物,该物质的分子空间构型为______________;该化合物中B原子的杂化轨道类型为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。[配制酸性KMnO4标准溶液]如图是配制50mL酸性KMnO4标准溶液的过程示意图。
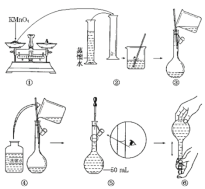
(1)请你观察图示判断其中不正确的操作有________(填序号)。
(2)其中确定50mL溶液体积的容器是__________________________________(填名称)。
(3)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测得的实验结果将______(填“偏大”或“偏小”)。
[测定血液样品中Ca2+的浓度]抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol·L-1酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL酸性KMnO4溶液。
(4)已知草酸与酸性KMnO4溶液反应的离子方程式为:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O滴定时,根据现象_______________________________________,即可确定反应达到终点。
(5)经过计算,血液样品中Ca2+的浓度为________mg·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com