
【题目】氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)![]() 2NH3(g) △H。
2NH3(g) △H。
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N≡N |
435.9kJ | 390.8kJ | 192.8kJ | 945.8kJ |
则△H=_____________。
(2)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示。
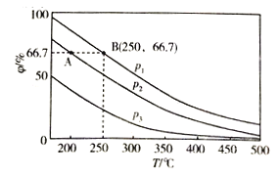
①其中,p1、p2和p3由大到小的顺序是________,其原因是__________。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)____vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=______________(保留一位小数)。
(3)H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s) ![]() 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)。
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)。
①混合气体的压强不变 ④混合气体的平均相对分子质量不变
②混合气体的密度不变 ⑤NH3的体积分数不变 ③混合气体的总物质的量不变
【答案】-91.3kJ/mol p1>p2>p3 温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大 < 5925.9L2/mol2 ①②③
【解析】
根据键能数据求反应热;根据平衡移动原理并结合图象分析有关的反应条件的大小关系;根据化学平衡状态的特征分析反应是否达到化学平衡。
(1)△H=反应物的键能总和-生成物的键能总和=435.9kJ/mol![]() 3+945.8kJ/mol-390.8kJ/mol
3+945.8kJ/mol-390.8kJ/mol![]() 6=-91.3kJ/mol。
6=-91.3kJ/mol。
(2)①由图象可知,在相同的温度下,平衡后混合物中氨的体积分数(φ),按p1、p2、p3顺序依次减小,由于该反应是一个气体分子数减小的反应,压强越大则氨的体积分数越大,因此p1、p2和p3由大到小的顺序是p1>p2>p3,其原因是:温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,由图象可知,A点的温度和压强均小于B点,则vA(N2)<vB(N2)。
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,初始时N2、H2分别为0.1mol、0.3mol。设N2、H2的变化是分别为x和3x,则N2、H2的平衡量分别为(0.1mol-x)、(0.3mol-3x),NH3的平衡量为2x,由于该条件下,在平衡混合物中氨的体积分数为66.7%,则有![]() ,解之得x=0.08mol,因为容器的体积为1L,所以合成氨的平衡常数K=
,解之得x=0.08mol,因为容器的体积为1L,所以合成氨的平衡常数K=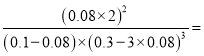 5925.9L2/mol2。
5925.9L2/mol2。
(3)在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s) ![]() 2NH3(g)+CO2(g)。该反应是一个气体分子数增多的吸热反应。
2NH3(g)+CO2(g)。该反应是一个气体分子数增多的吸热反应。
①混合气体的压强不变,说明气体的分子数不变,达到平衡;
②反应过程中,不断有固体转化为气体,气体的质量增大,则气体的密度增大,故当混合气体的密度不变时,达到平衡;
③混合气体的总物质的量不变说明气体的分子数不变,达到平衡。
④因为反应物只有固体,所以混合气体的平均相对分子质量在反应开始后一直不变,故无法据此判断是否达到平衡;
⑤NH3的体积分数在反应混合气中是定值,无法据此判断是否达到平衡;
综上所述,能说明该反应达到平衡状态的是①②③。


科目:高中化学 来源: 题型:
【题目】(Ti)及其化合物大量应用于航空、造船、电子、化学、医疗器械、电讯器材等各个领域,工业上常以金红石(主要成分是TiO2)、焦炭、氯气、金属镁为原料生产金属钛,其流程如下:

(1)过程Ⅰ中,可燃性气体X是______。
(2)过程Ⅱ中,发生反应的化学方程式是______;稀有气体的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
A | B | C | D |
|
|
|
|
升高温度,正反应方向平衡常数减小 | 0~3s内,反应速率为:v(NO2)=0.2 mol·L-1·s-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示,根据图中数据填空:
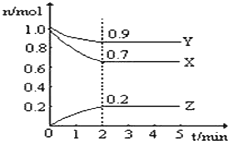
(1)该反应的化学方程式为______________________________;
(2)反应开始至2min,以气体Z表示的平均反应速率为__________;
(3)平衡时容器内混合气体密度比起始时________(填“变大”,“变小”或“相等”下同),混合气体的平均相对分子质量比起始时_________;
(4)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是_________。
2HI(g)达到平衡状态的是_________。
(2)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是________。
C(g)+D(g)达到平衡状态的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化介物H是一种有机光电材料中间体。实验室由芳香化合物A制务H的一种合成路线如下:
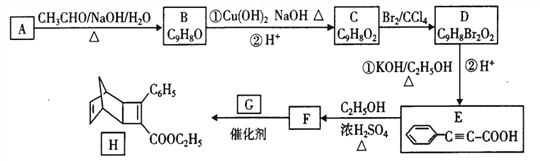
已知:①![]()
②![]()
回答下列问题:
(1)E中的官能团名称为____________和_______________。
(2)C→D的反应类型为___________,B→C的化学反应方程式为_________________。
(3)G的结构简式为_______________。
(4)写出同时满足下列条件的F的一种同分异构体的结构简式______________。
①遇FeCl3溶液显紫色; ②能发生银镜反应; ③分子中有5种不同化学环境的氢且个数比为1:1:2:2:4。
(5)写出用甲醛和乙烯为原料制备化合物C(CH2ONO2)的合成路线(其他无机试剂任选,合成路线流程图示例见本题题干)。_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以某种比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是
A. CH4、C2H4 B. CH4、C3H6 C. C2H4、C3H4 D. C2H2、C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
A. 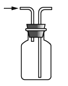 收集 NOB.
收集 NOB.  制备 NH3
制备 NH3
C.  制备 Fe(OH)2D.
制备 Fe(OH)2D. 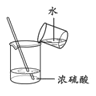 稀释浓 H2SO4
稀释浓 H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
A. x=1
B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1
D. 达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com