
【题目】某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示。由图中数据该反应的化学方程式为:________。反应开始至2min,Z的平均反应速率为________

【答案】3X+Y2Z 0.05mol/(Lmin)
【解析】
根据图象可知,X、Y物质的量减少,Z物质的量增加,X、Y是反应物,Z是生成物;反应进行到2min时,各种物质的物质的量不在发生变化,说明反应达到平衡状态,此时X、Y、Z的物质的量的变化量分别是(mol)1.0-0.7=0.3、1.0-0.9=0.1、0.2-0=0.2,变化量之比是相应的化学计量数之比。
(1)根据图象可知,X、Y物质的量减少,Z物质的量增加,X、Y是反应物,Z是生成物;反应进行到2min时,各种物质的物质的量不在发生变化,说明反应达到平衡状态,此时X、Y、Z的物质的量的变化量分别是(mol)1.0-0.7=0.3、1.0-0.9=0.1、0.2-0=0.2,变化量之比是相应的化学计量数之比,所以反应方程式是3X+Y![]() 2Z;反应开始至2min,Z的物质的量变化是0.2mol,平均反应速率为
2Z;反应开始至2min,Z的物质的量变化是0.2mol,平均反应速率为![]() (Z)=
(Z)= 0.05mol/(Lmin)。
0.05mol/(Lmin)。


科目:高中化学 来源: 题型:
【题目】化学与生产、生活及环境密切相关,下列有关说法不正确的是( )
A.餐具上的油污可用热的纯碱溶液清洗,纺织品上的油污不可以用烧碱溶液清洗
B.工业生产时加入适宜的催化剂,除了可以加快反应速率之外,还可以降低反应所需的温度,从而减少能耗
C.一定条件下,1mol 化合物X(![]() )最多可以与2molNaOH反应
)最多可以与2molNaOH反应
D.用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
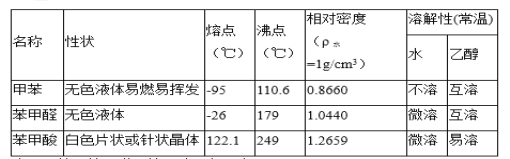
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入2mL甲苯和一定量其它试剂,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
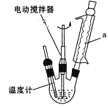
(1)装置a的名称是___,主要作用是___。三颈瓶中发生反应的化学方程式为___。
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是___。
(3)反应完毕,反应混合液经过自然冷却至室温后,还应经过__、__(填操作名称)等操作,才能得到苯甲醛粗产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的实验步骤是___(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.与适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸(相对分子质量为122)产品进行纯度测定,可称取2.5g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.0mL于锥形瓶,加入0.1mol/LKOH溶液18.0mL恰好反应,产品中苯甲酸的质量分数为__(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4Br置于密闭容器中,在某温度下,发生下列反应:NH4Br(s)═NH3(g)+HBr(g),2HBr(g)Br2(g)+H2(g)。2min时,测知H2的浓度为0.5molL﹣1,HBr的浓度为4molL﹣1,若上述反应速率用v(NH3)表示,下列速率正确的是( )
A.0.5molL﹣1min﹣1B.2.5molL﹣1min﹣1 C.2molL﹣1min﹣1 D.5molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应2A![]() B+3C在下列四种状态中,处于平衡状态的是
B+3C在下列四种状态中,处于平衡状态的是
A. 正反应速率vA=2 mol/(L·min),逆反应速率vB=2 mol/(L·min)
B. 正反应速率vA=2 mol/(L·min),逆反应速率vC=2 mol/(L·min)
C. 正反应速率vA=1 mol/(L·min),逆反应速率vB=1.5 mol/(L·min)
D. 正反应速率vA=1 mol/(L·min),逆反应速率vC=1.5 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A.放电时负极反应为:Zn+2OH--2e-=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3+5OH--3e-=FeO42-+4H2O
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则甲烷燃烧的热化学方程式为__。
Ⅱ科研人员新近开发出一种由甲醇(CH3OH)和氧气以及强碱做电解质溶液的新型手机电池,可供手机连续使用一个月才充一次电,据此请回答以下问题:
(1)甲醇是__极,电极反应为___。
(2)电池反应的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害。
Ⅰ.已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=+571.2kJ·mol-1
BaS(s)=Ba(s)+S(s) ΔH=+460kJ·mol-1
已知:2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s)ΔH=__。
Ⅱ.SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法
反应原理:恒温恒容时2C(s)+2SO2(g)=S2(g)+2CO2(g)。
反应进行到不同时间测得各物质的浓度如图:
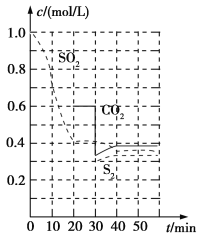
①0~20min反应速率表示为v(SO2)=__;
②30min时,改变某一条件平衡发生移动,则改变的条件最有可能是__;
③40min时,平衡常数K=__。
(2)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为__;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是__(填序号)。
a.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
c.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
d.溶液中c(H+)=1×10-8mol/L
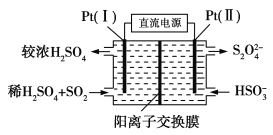
(3)电化学处理法
①如图所示,Pt(Ⅰ)电极的反应式为__;
②当电路中转移0.02mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加__mol离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄是一种常见水果,可以生食或制作葡萄干,除此之外,葡萄还可用于酿酒。
(1)检验葡萄汁含有葡萄糖的方法是:向其中加碱调至碱性,再加入新制的Cu(OH)2并加热,其现象是________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式:C6H12O6(葡萄糖)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)葡萄酒密封储存过程中会生成有香味的酯类,酯类也可以通过化学实验来制备,实验室可用如图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是__________。
②试管b中盛放的试剂是饱和____________溶液。
③实验开始时,试管b中的导管不伸入液面下的原因是________。
④若要分离出试管b中的乙酸乙酯,需要用到的仪器是_______(填字母)。
A.普通漏斗 B.分液漏斗 C.长颈漏斗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com