
【题目】在一定条件下,可逆反应2A![]() B+3C在下列四种状态中,处于平衡状态的是
B+3C在下列四种状态中,处于平衡状态的是
A. 正反应速率vA=2 mol/(L·min),逆反应速率vB=2 mol/(L·min)
B. 正反应速率vA=2 mol/(L·min),逆反应速率vC=2 mol/(L·min)
C. 正反应速率vA=1 mol/(L·min),逆反应速率vB=1.5 mol/(L·min)
D. 正反应速率vA=1 mol/(L·min),逆反应速率vC=1.5 mol/(L·min)
【答案】D
【解析】
达到平衡状态时,用不同物质表示的正逆反应速率数值之比等于其化学计量数之比。
A. 正反应速率vA=2 mol/(L·min),逆反应速率vB=2 mol/(L·min),v正≠v逆,没有达到平衡状态,应为vA正=2vB逆,故A不选;
B. 正反应速率vA=2 mol/(L·min),逆反应速率vC=2 mol/(L·min),v正≠v逆,没有达到平衡状态,应为3vA正=2vC逆,故B不选;
C. 正反应速率vA=1 mol/(L·min),逆反应速率vB=1.5 mol/(L·min),v正≠v逆,没有达到平衡状态,应为vA正=2vB逆,故C不选;
D. 正反应速率vA=1 mol/(L·min),逆反应速率vC=1.5 mol/(L·min),3vA正=2vC逆,即v正=v逆,达到平衡状态,故D选,答案选D。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案科目:高中化学 来源: 题型:
【题目】有机物X是重要的有机化工原料,Y是一种功能高分子材料,下面为各物质之间的转化关系(部分产物、合成路线、反应条件略去)。
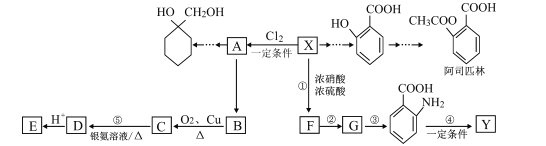
已知:①X为芳香烃,其相对分子质量为92;
②烷基苯在高锰酸钾的作用下,侧链被氧化成羧基![]() ;
;
③![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)E的分子式为___,反应②的反应类型是___。
(2)1mol阿司匹林最多能与___mol氢氧化钠溶液反应。
(3)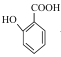 与少量碳酸氢钠反应的化学方程式___。
与少量碳酸氢钠反应的化学方程式___。
(4)反应④的化学方程式为___。
(5)比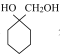 少一个碳原子的有机物(分子式为C6H12O2)有多种同分异构体,其中同时符合下列条件的有___种。
少一个碳原子的有机物(分子式为C6H12O2)有多种同分异构体,其中同时符合下列条件的有___种。
①能与金属钠反应 ②含两个甲基 ③能发生银镜反应;
其中核磁共振氢谱为6:2:2:1:1的有机物结构简式为___ (只写任意一种)。
(6)参照上述合成路线,结合所学知识,写出以A为原料制备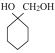 的合成路线___。
的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼的无机化学问题比周期表里任何一种元素都更复杂和变化多端。
(1)基态B原子的价电子轨道表达式为__,第二周期第一电离能比B高的元素有__种。
(2)B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为__(标出配位键),其中心原子的VSEPR模型名称为__,写出[BH4]-的两种等电子体__。
(3)图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为__(以n表示硼原子的个数),图2表示的是一种五硼酸根离子,其中B原子的杂化方式为__。
图1 | 图2 | 图3 |
|
|
|
(4)硼酸晶体是片层结构,图3表示的是其中一层的结构。同一层微粒间存在的作用力有__。
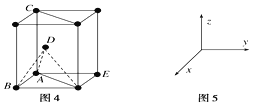
(5)1892年,化学家已用Mg还原B2O3制得硼单质。Mg属六方最密堆积,其晶胞结构如图4所示,若在晶胞中建立如图5所示的坐标系,以A为坐标原点,把晶胞的底边边长和高都视作单位1,则B、E、C的坐标分别为B(1,0,0)、E(0,1,0)、C(0,0,1),请写出D点的坐标:D:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某烷烃相对相对分子量为72,该烃的化学式是 ______ ,它有 ______ 种同分异构体,其中沸点最高的是 ______ (填结构简式)其核磁共振氢谱中只有一种峰,则它的结构简式为 ______
(2)分子式为C8H10有多种同分异构体,其中属于芳香烃,且苯环上的一氯取代物只有一种,请写出该芳香烃的结构简式________。
(3)按要求写出下列化学方程式:
①制取乙炔的化学方程式:______
②丙烯→聚丙烯______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应平衡常数K= ![]() 。恒容条件下达到平衡时,温度升高H2浓度减小。下列说法正确的是( )
。恒容条件下达到平衡时,温度升高H2浓度减小。下列说法正确的是( )
A.该反应的化学方程式为CO+H2O ![]() CO2+H2B.该反应的焓变为正值
CO2+H2B.该反应的焓变为正值
C.恒温恒容下,增大压强,H2浓度一定减小 D.升高温度,平衡右移,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示。由图中数据该反应的化学方程式为:________。反应开始至2min,Z的平均反应速率为________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用生物电化学方法脱除水体中NH4+的原理如图所示。
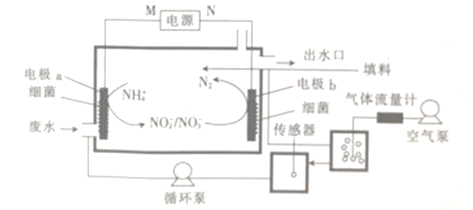
下列说法正确的是
A. M为电源的负极,N为电源的正极
B. 装置工作时,电极a周围溶液的pH降低
C. 装置内工作温度越高,NH4+的脱除率一定越大
D. 电极b上发生的反应之一为2NO2-+8H++8e-=N2↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是( )
A.1mol甲苯含有6NA个C-H键
B.5NH4NO3![]() 2HNO3+4N2↑+9H2O的反应中,生成28gN2,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O的反应中,生成28gN2,转移的电子数目为3.75NA
C.标准状况下,22.4L氨水含有NA个NH3分子
D.56g铁片投入足量浓硫酸中生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒化铜纳米晶体在光电转化中有着广泛的应用,铜和硒等元素形成的化合物在生产、生活中应用广泛。

(1)基态硒原子的核外电子排布式为______。As、Se、Br三种元素第一电离能由大到小的顺序为______。
(2)SeO2易溶解于水,熔点为340~350℃,315℃时升华,由此可判断SeO2中的化学键类型为______。
(3)Se2Cl2为深棕红色的剧毒液体,其分子结构中含有Se-Se 键,该分子中,Se原子的杂化轨道类型为______,Se2Cl2的空间构型为______(填字母)。
a.直线形 b.锯齿形 c.环形 d.四面体形
(4)硒酸钢(CuSeO4)在电子、仪表工业中发挥着重要作用。硒酸的酸性与硫酸的比较,酸性较强的是______(填化学式)。
(5)SeO42-中Se-O的键角比SeO3的键角______(填“大“或“小“),原因是______。
(6)铜的某种氧化物的晶胞结构如图所示,则该氧化物的化学式为______,若组成粒子氧、铜的半径分别为r(O)pm、r(Cu)pm,密度为ρgcm-3,阿伏加德罗常数的值为NA,则该晶胞的空间利用率为______(用含π的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com