
【题目】(1)某烷烃相对相对分子量为72,该烃的化学式是 ______ ,它有 ______ 种同分异构体,其中沸点最高的是 ______ (填结构简式)其核磁共振氢谱中只有一种峰,则它的结构简式为 ______
(2)分子式为C8H10有多种同分异构体,其中属于芳香烃,且苯环上的一氯取代物只有一种,请写出该芳香烃的结构简式________。
(3)按要求写出下列化学方程式:
①制取乙炔的化学方程式:______
②丙烯→聚丙烯______;
【答案】![]() 3
3 ![]()
![]()
![]()
![]()
![]()
【解析】
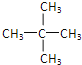
某烷烃相对分子量为72,烷烃的组成通式为CnH2n+2,则:14n+2=72,解得:n=5,故该烷烃的分子式为C5H12;戊烷分子中,所有的碳原子在一条链上:CH3-CH2-CH2-CH2-CH3;拿下1个碳原子作为支链为CH3CH(CH3)CH2CH3;拿下2个碳原子作为支链: CH3-C(CH3)2-CH3,所以戊烷存在3种同分异构体;戊烷分子中支链越多沸点越低,所以沸点最高的为正戊烷,其结构简式为: CH3-CH2-CH2-CH2-CH3; 核磁共振氢谱中只有一种峰,则它的结构简式为 C(CH3)4;答案:C5H12;3;CH3-CH2-CH2-CH2-CH3;C(CH3)4;
(2)苯环上的一氯取代物只有一种,说明苯环上只有一种氢原子,则2个碳原子不可能是形成1个乙基,只能是2个甲基,且处于对位,其结构简式为:![]() ,答案:
,答案: ![]() ;
;
(3)①实验室中用碳化钙与水反应生成乙炔,反应的化学方程式为:CaC2+2H2O→Ca(OH)2+CH![]() CH↑;故答案为: CaC2+2H2O→Ca(OH)2+CH
CH↑;故答案为: CaC2+2H2O→Ca(OH)2+CH![]() CH↑;
CH↑;
②丙烯中含C=C,发生加聚反应生成聚丙烯,化学方程式为 。
。


科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
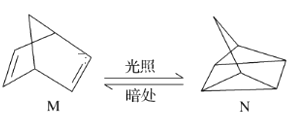
(1)有机物M经过太阳光光照可转化成N,转化过程如下,ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是________。
(2)已知CH3OH(l)的燃烧热ΔH=-726.5 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1则a________726.5(填“>”“<”或“=”)
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1则a________726.5(填“>”“<”或“=”)
(3)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145.0 kJ热量,写出该反应的热化学方程式:________________________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1 176.0 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为_______。
(5) 已知:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的 ΔH=__________________。
(6)已知拆开1 mol H—H键,1 mol N—H键,1mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.200g63%的浓硝酸中含氧原子个数为6NA
B.14g乙烯和环丙烷混合物含有的氢原子数目为2NA
C.46gNa与一定量O2完全反应生成Na2O和Na2O2,转移电子数为3NA
D.将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
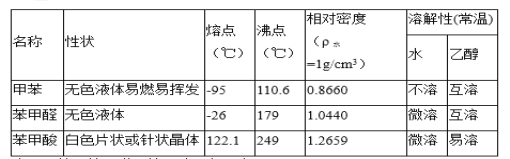
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入2mL甲苯和一定量其它试剂,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
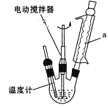
(1)装置a的名称是___,主要作用是___。三颈瓶中发生反应的化学方程式为___。
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是___。
(3)反应完毕,反应混合液经过自然冷却至室温后,还应经过__、__(填操作名称)等操作,才能得到苯甲醛粗产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的实验步骤是___(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.与适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸(相对分子质量为122)产品进行纯度测定,可称取2.5g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.0mL于锥形瓶,加入0.1mol/LKOH溶液18.0mL恰好反应,产品中苯甲酸的质量分数为__(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的三个不同短周期主族元素,无色气体![]() 遇空气变色,Z所在族的各元素的氢化物的水溶液均显酸性,下列说法正确的是( )
遇空气变色,Z所在族的各元素的氢化物的水溶液均显酸性,下列说法正确的是( )
A.Z单质的沸点低,故Z单质易液化
B.原子半径:![]()
C.最高价氧化物对应水化物的酸性:![]()
D.X、Y、Z与W均能形成既有极性键又有非极性键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4Br置于密闭容器中,在某温度下,发生下列反应:NH4Br(s)═NH3(g)+HBr(g),2HBr(g)Br2(g)+H2(g)。2min时,测知H2的浓度为0.5molL﹣1,HBr的浓度为4molL﹣1,若上述反应速率用v(NH3)表示,下列速率正确的是( )
A.0.5molL﹣1min﹣1B.2.5molL﹣1min﹣1 C.2molL﹣1min﹣1 D.5molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应2A![]() B+3C在下列四种状态中,处于平衡状态的是
B+3C在下列四种状态中,处于平衡状态的是
A. 正反应速率vA=2 mol/(L·min),逆反应速率vB=2 mol/(L·min)
B. 正反应速率vA=2 mol/(L·min),逆反应速率vC=2 mol/(L·min)
C. 正反应速率vA=1 mol/(L·min),逆反应速率vB=1.5 mol/(L·min)
D. 正反应速率vA=1 mol/(L·min),逆反应速率vC=1.5 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则甲烷燃烧的热化学方程式为__。
Ⅱ科研人员新近开发出一种由甲醇(CH3OH)和氧气以及强碱做电解质溶液的新型手机电池,可供手机连续使用一个月才充一次电,据此请回答以下问题:
(1)甲醇是__极,电极反应为___。
(2)电池反应的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)聚乙烯的结构单元是__,聚合度(n)表示__。聚乙烯的单体是__(填结构简式)。
(2)单个高分子的相对分子质量是__;某种高分子材料从实验中测得的相对分子质量为___。
(3)高分子化合物中的单体是指__;聚合度是指___。
(4)某直链纤维素分子的相对分子质量为110000,它的分子里含有__个C6H10O5这样的结构单元。
(5)从高分子的结构特点来解释为什么高分子材料的强度较大,一般不易导电。__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com