
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是( )
A.1mol甲苯含有6NA个C-H键
B.5NH4NO3![]() 2HNO3+4N2↑+9H2O的反应中,生成28gN2,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O的反应中,生成28gN2,转移的电子数目为3.75NA
C.标准状况下,22.4L氨水含有NA个NH3分子
D.56g铁片投入足量浓硫酸中生成NA个SO2分子
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.200g63%的浓硝酸中含氧原子个数为6NA
B.14g乙烯和环丙烷混合物含有的氢原子数目为2NA
C.46gNa与一定量O2完全反应生成Na2O和Na2O2,转移电子数为3NA
D.将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应2A![]() B+3C在下列四种状态中,处于平衡状态的是
B+3C在下列四种状态中,处于平衡状态的是
A. 正反应速率vA=2 mol/(L·min),逆反应速率vB=2 mol/(L·min)
B. 正反应速率vA=2 mol/(L·min),逆反应速率vC=2 mol/(L·min)
C. 正反应速率vA=1 mol/(L·min),逆反应速率vB=1.5 mol/(L·min)
D. 正反应速率vA=1 mol/(L·min),逆反应速率vC=1.5 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则甲烷燃烧的热化学方程式为__。
Ⅱ科研人员新近开发出一种由甲醇(CH3OH)和氧气以及强碱做电解质溶液的新型手机电池,可供手机连续使用一个月才充一次电,据此请回答以下问题:
(1)甲醇是__极,电极反应为___。
(2)电池反应的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,⑦(NH4)2SO4,⑧乙醇中,由极性键形成的非极性分子有_______(填序号,以下同),含有金属离子的物质是__,分子间可形成氢键的物质是________,属于离子晶体的是__,属于原子晶体的是__,①~⑤五种物质的熔点由高到低的顺序是__。
(2)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__。
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.__;B.__;C.__D.____。
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害。
Ⅰ.已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=+571.2kJ·mol-1
BaS(s)=Ba(s)+S(s) ΔH=+460kJ·mol-1
已知:2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s)ΔH=__。
Ⅱ.SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法
反应原理:恒温恒容时2C(s)+2SO2(g)=S2(g)+2CO2(g)。
反应进行到不同时间测得各物质的浓度如图:
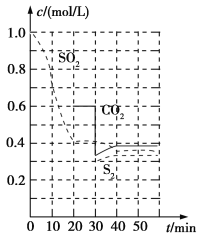
①0~20min反应速率表示为v(SO2)=__;
②30min时,改变某一条件平衡发生移动,则改变的条件最有可能是__;
③40min时,平衡常数K=__。
(2)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为__;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是__(填序号)。
a.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
c.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
d.溶液中c(H+)=1×10-8mol/L
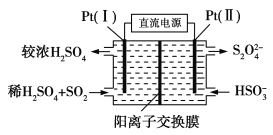
(3)电化学处理法
①如图所示,Pt(Ⅰ)电极的反应式为__;
②当电路中转移0.02mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加__mol离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W,已知X的某种氢化物可使溴的四氯化碳溶液褪色,X原子电子占据2个电子层;Y广泛作电池材料且单位质量的金属提供电子数目最多;实验室可用Z的简单氢化物的浓溶液和KMnO4固体在常温下制备Z的单质:向含W元素的钠盐溶液中通入x的氧化物,观察到沉淀质量(m)与X的氧化物体积(V)关系如图所示。下列说法正确的是( )
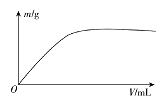
A.Y的单质在空气中燃烧生成过氧化物和氮化物
B.W一定位于周期表中第三周期IIIA族
C.X的含氧酸的酸性可能比Z的含氧酸的酸性强
D.Z和W组成的化合物可能是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)聚乙烯的结构单元是__,聚合度(n)表示__。聚乙烯的单体是__(填结构简式)。
(2)单个高分子的相对分子质量是__;某种高分子材料从实验中测得的相对分子质量为___。
(3)高分子化合物中的单体是指__;聚合度是指___。
(4)某直链纤维素分子的相对分子质量为110000,它的分子里含有__个C6H10O5这样的结构单元。
(5)从高分子的结构特点来解释为什么高分子材料的强度较大,一般不易导电。__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素的性质或结构信息如下表所示。请根据信息回答下列问题。
元素 | T | X | Y | Z |
性质或结构信息 | 原子核外s能级上的电子总数等于p能级上的电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 | 其单质为双原子分子,分子中含有3对共用电子对,常温下其气体单质性质稳定,但其原子较活泼 | 其单质质软,是银白色固体,导电性强。单质在空气中燃烧发出黄色火焰 | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的离子结构示意图:______;写出元素X的气态氢化物的分子式:______;写出Z元素原子的核外电子排布式:________;元素Y的原子核外共有_______种形状不同的电子云。
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式:______。
(3)元素T与氟元素相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是___(填字母)。
a.常温下氟气的颜色比T单质的深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素显正价
d.比较两元素的单质与氢气化合时得电子的数目
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com