
【题目】高温下,某反应平衡常数K= ![]() 。恒容条件下达到平衡时,温度升高H2浓度减小。下列说法正确的是( )
。恒容条件下达到平衡时,温度升高H2浓度减小。下列说法正确的是( )
A.该反应的化学方程式为CO+H2O ![]() CO2+H2B.该反应的焓变为正值
CO2+H2B.该反应的焓变为正值
C.恒温恒容下,增大压强,H2浓度一定减小 D.升高温度,平衡右移,逆反应速率减小
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中,c(H+)由小到大的排列顺序是________
①0.1mol/L HCl溶液 ②0.1mol/L H2SO4溶液 ③0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在给定条件下的同分异构体数目正确的是( )
A. C4H10属于烷烃的同分异构体有3种
B. 分子组成是C5H10O2属于羧酸的同分异构体有5种
C. 分子组成是C4H8O属于醛的同分异构体有3种
D. 结构简式为![]() 的一溴代物有5种
的一溴代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的三个不同短周期主族元素,无色气体![]() 遇空气变色,Z所在族的各元素的氢化物的水溶液均显酸性,下列说法正确的是( )
遇空气变色,Z所在族的各元素的氢化物的水溶液均显酸性,下列说法正确的是( )
A.Z单质的沸点低,故Z单质易液化
B.原子半径:![]()
C.最高价氧化物对应水化物的酸性:![]()
D.X、Y、Z与W均能形成既有极性键又有非极性键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。
(1)下列仪器中,与该滴定实验无关的为______。
A 胶头滴管 B 量筒(10ml) C 锥形瓶 D 滴定管夹
(2)量取一定体积的白醋所用的仪器_______(填“酸式”或“碱式”)滴定管. 实验中应选用______作指示剂。
(3)滴定过程中进行如下操作,分别指出该项操作对滴定结果的影响(填“偏高”、“偏低”或“无影响”)
Ⅰ滴定前未用标准液润洗碱式滴定管______;
Ⅱ滴定结束时俯视滴定管刻度______
Ⅲ 盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失______
(4)在滴定过程中,当c(CH3COOˉ)< c(Na+)时,则混合溶液呈____(填序号)。
A 酸性 B 碱性 C 中性 D 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应2A![]() B+3C在下列四种状态中,处于平衡状态的是
B+3C在下列四种状态中,处于平衡状态的是
A. 正反应速率vA=2 mol/(L·min),逆反应速率vB=2 mol/(L·min)
B. 正反应速率vA=2 mol/(L·min),逆反应速率vC=2 mol/(L·min)
C. 正反应速率vA=1 mol/(L·min),逆反应速率vB=1.5 mol/(L·min)
D. 正反应速率vA=1 mol/(L·min),逆反应速率vC=1.5 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1mol·L-1的某二元酸H2A溶液中,逐渐加入NaOH溶液,可能存在的含A粒子的物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
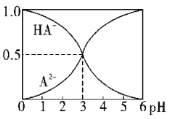
A.H2A的电离方程式:H2A![]() H++HA-
H++HA-
B.pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100
C.等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(A2-)>c(HA-)
D.Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,⑦(NH4)2SO4,⑧乙醇中,由极性键形成的非极性分子有_______(填序号,以下同),含有金属离子的物质是__,分子间可形成氢键的物质是________,属于离子晶体的是__,属于原子晶体的是__,①~⑤五种物质的熔点由高到低的顺序是__。
(2)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__。
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.__;B.__;C.__D.____。
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M 的结构简式如下:下列有关M 叙述不正确的是( )

A. M的分子式为C11H12O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下,M能生成高分子化合物
D. 能发生加成反应不能发生取代反应
【答案】D
【解析】
试题A.根据物质的结构简式可知M的分子式是C11H12O3,正确; B.该物质的分子中含有碳碳双键,因此能使溴的四氯化碳溶液褪色,正确;C. 该物质的分子中含有碳碳双键,在一定条件下发生加聚反应形成高聚物,正确;D. 化合物M含有碳碳双键,因此能发生加成反应,含有醇羟基、羧基,因此可以发生取代反应,错误。
考点:考查有机物的结构与性质的关系的知识。
【题型】单选题
【结束】
22
【题目】下列有关金属腐蚀与防护的说法不正确的是( )
A. 钢铁发生电化学腐蚀时,若表面水膜呈中性,则正极发生的反应为:2H2O+O2+4e一= 4OH一
B. 在潮湿的空气中,黄铜(铜锌合金)制品比纯铜制品更易产生铜绿
C. 金属制品在海水中比淡水中更容易发生腐蚀
D. 从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程
【答案】B
【解析】A、钢铁发生电化学腐蚀时,若表面水膜呈中性发生吸氧腐蚀,则正极发生的反应为:2H2O+O2+4e一=4OH一,A正确;B、在潮湿的空气中易发生电化学腐蚀,锌的金属性强于铜,因此黄铜(铜锌合金)制品比纯铜制品更不易产生铜绿,B错误;C、海水中含电解质浓度大,淡水中含电解质浓度小,故金属制品在海水中比淡水中更容易发生腐蚀,C正确;D、从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程,D正确;答案选B。
【题型】单选题
【结束】
23
【题目】下列说法不正确的是
A. 麦芽糖及其水解产物均能发生银镜反应
B. 用溴水即可鉴别苯酚溶液,2,4-已二烯和甲苯
C. 在酸性条件下,![]() 的水解产物是
的水解产物是![]() 和
和![]()
D. 用甘氨酸![]() 和丙氨酸
和丙氨酸![]() 缩合最多可形成4种二肽
缩合最多可形成4种二肽
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com