
【题目】利用含铬废料(主要含 Cr2O3,还含有 FeO、SiO2、Al2O3 等杂质)制备重铬酸钠,实现清洁化工生产,工艺流程如图:
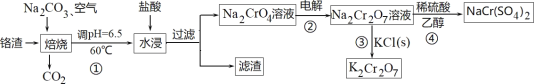
回答下列问题:
(1)焙烧 Cr2O3 转化为Na2CrO4 的化学反应方程式是_____;
(2)实验室模拟此工业流程①,控制反应温度 60℃的方法是_____;
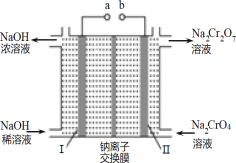
(3)流程②用石墨做电极电解 Na2CrO4 溶液,制备Na2Cr2O7,其原理如图所示,a 是_____极;电极Ⅱ的电极反应式是_____;当生成 2mol Na2Cr2O7时,电路中转移的电子_____mol;
(4)由下图和下表中的溶解度变化,流程③制备 K2Cr2O7,应先充分加热,然后_____反应才能顺利进行;

重铬酸钠的溶解度表:
温度℃ | 10 | 20 | 40 | 60 | 80 | 100 |
溶解度% | 61.6 | 62.8 | 65.1 | 71.8 | 78.7 | 81.1 |
(5)为进一步减少制得的 K2Cr2O7 晶体中 NaCl 等杂质,应再进行_____操作;
(6)流程④Na2Cr2O7 溶液与乙醇反应,乙醇可能被氧化为_____(写一种即可)。
【答案】2Cr2O3+4Na2CO3+3O2 ![]() 4Na2CrO4+4CO2 水浴加热 负极 4OH-―4e-=2H2O+O2↑或2H2O-4e-=O2↑+4H+ 4 冷却结晶(降低温度) 重结晶 乙醛(CH3CHO)、乙酸(CH3COOH)、二氧化碳(CO2)等
4Na2CrO4+4CO2 水浴加热 负极 4OH-―4e-=2H2O+O2↑或2H2O-4e-=O2↑+4H+ 4 冷却结晶(降低温度) 重结晶 乙醛(CH3CHO)、乙酸(CH3COOH)、二氧化碳(CO2)等
【解析】
利用含铬废料(主要含 Cr2O3,还含有 FeO、SiO2、Al2O3 等杂质)制备重铬酸钠。将铬铁矿和碳酸钠、空气混合焙烧,发生反应得到Na2CrO4、NaAlO2、Na2SiO3等和CO2,然后在60℃时调节溶液的pH=6.5,用盐酸浸取后过滤,得到的滤渣中主要含有硅酸、氢氧化铁、氢氧化铝等,滤液中含有Na2CrO4和NaCl,然后用石墨做电极电解 Na2CrO4 溶液,制备Na2Cr2O7,在Na2Cr2O7溶液中加入氯化钾固体可以制得K2Cr2O7,在Na2Cr2O7溶液中加入稀硫酸和乙醇,可以制得Na Cr(SO4)2,据此分析解答。
(1)Cr2O3 与碳酸钠在空气中焙烧反应生成Na2CrO4 的化学反应方程式为2Cr2O3+4Na2CO3+3O2 ![]() 4Na2CrO4+4CO2,故答案为:2Cr2O3+4Na2CO3+3O2
4Na2CrO4+4CO2,故答案为:2Cr2O3+4Na2CO3+3O2 ![]() 4Na2CrO4+4CO2;
4Na2CrO4+4CO2;
(2)可以采用水浴加热的方法,控制反应温度 60℃,故答案为:水浴加热;
(3)Na2CrO4 溶液中存在2CrO42-+2H+Cr2O72-+H2O,用图示装置(均为石墨电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明该电极(电极Ⅱ)是阳极,连接电源的正极,即b为正极,则a为负极;电极Ⅱ为阳极,溶液中氢氧根离子失电子生成氧气,电极反应式为4OH--4e-=2H2O+O2↑或2H2O-4e-=O2↑+4H+;由CrO42-+2H +=Cr2O72-+H2O可知,每生成2molNa2Cr2O7时,理论上II电极生成4molH+,根据阳极反应式4OH--4e-=2H2O+O2↑可知,每生成4molH+,转移4mol电子,故答案为:负极;4OH-―4e-=2H2O+O2↑或2H2O-4e-=O2↑+4H+;4;
(4) 根据溶解度曲线和重铬酸钠的溶解度表可知,K2Cr2O7的溶解度随温度的变化较大,而Na2Cr2O7的溶解度受温度的影响不大,且温度较低是由水中的溶解度:Na2Cr2O7>K2Cr2O7,因此流程③中向Na2Cr2O7溶液中加入适量KCl,充分加热,蒸发浓缩至表面出现晶膜,然后冷却结晶,析出K2Cr2O7固体,反应才能顺利进行,故答案为:冷却结晶(降低温度);
(5) 根据溶解度曲线,K2Cr2O7的溶解度随温度的变化较大,而氯化钠的溶解度受温度的影响不大,为进一步减少制得的 K2Cr2O7 晶体中 NaCl 等杂质,需要对K2Cr2O7 晶体进行重结晶操作,进一步分离提纯,故答案为:重结晶;
(6) Na2Cr2O7 溶液具有强氧化性,Na2Cr2O7 溶液与乙醇反应,乙醇可能被氧化为乙醛(CH3CHO)、乙酸(CH3COOH)、甚至可以氧化生成二氧化碳和水,故答案为:乙醛(CH3CHO)、乙酸(CH3COOH)、二氧化碳


科目:高中化学 来源: 题型:
【题目】25℃,用0.1000mol/L的NaOH溶液滴定40.00mL0.1mol/L的某二元弱酸H2R溶液,所得滴定曲线如图所示(设所得溶液体积等于两种溶液体积之和)。下列说法正确的是
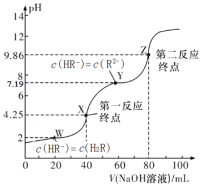
A.若只滴定到第一反应终点,可用酚酞做指示剂
B.图中Y点对应的溶液中:c(Na+)+c(H+)=2c(HR-)+c(OH-)
C.图中Z点对应的溶液中c(Na+)约为0.067mol/L,R2-的水解率大于1%
D.若pK=-lgK,2HR-![]() R2-+H2R达平衡时pK=5.19
R2-+H2R达平衡时pK=5.19
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,实验室制取高铁酸钠的化学方程式如下 :
(1)请用双线桥法表达出此反应的电子转移情况:__________
2Fe( NO3 )3+16NaOH+3Cl2=2Na2FeO4+6NaNO3 +6NaCl+8H2O
(2)若要制取8.3g高铁酸钠需要标准下Cl2的体积为多少?______若所用氢氧化钠溶液体积为200mL,则氢氧化钠溶液的物质的量浓度是多少?(写出计算过程)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A.稀释氨水溶液 10 倍后,其 c(OH-)为原来的![]()
B.pH 之和为 14 的 H2C2O4与 NaOH 溶液混合:c(Na+)+c(H+)=c(OH-)+ c(HC2O4-)
C.pH=5 的 H2S 溶液中,c(H+)=c(HS-)=1×10-5mol/L
D.将等物质的量的Na2CO3 和 NaHCO3 混合溶于水中![]() <1
<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类和氧化还原的描述正确的是( )
A.酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系
B.元素的单质可由氧化或还原含该元素的化合物来制得
C.得电子越多的氧化剂,其氧化性就越强;含最高价元素的化合物一定具有强的氧化性
D.烧碱、熟石灰均属于碱,酸、碱、盐之间发生的反应均属于复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下CH4、H2S、NH3均为气体,分别有①11.2L H2S②16g CH4③1.204×1024个NH3分子,下列物理量大小比较正确的是( )
A. 体积:②>③>①
B. 密度:③>②>①
C. 质量:③>②>①
D. 原子总数:③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】28g CO气体在1mol的氧气中燃烧后,所得的气体通过足量Na2O2固体中充分反应后,下列说法不正确的是( )
A. CO与氧气反应,只消耗了0.5mol氧气
B. 充分反应后Na2O2固体质量增加了28 g
C. 通过以上两步反应后余下氧气物质的量为0.5mol
D. 若2gH2替代 28g的CO发生上述反应,则Na2O2固体质量增加了2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想合成具有以下结构的四种烃分子,下列有关说法不正确的是( )

A. 1 mol甲分子内含有10 mol共价键
B. 由乙分子构成的物质不能发生氧化反应
C. 丙分子的二氯取代产物只有三种
D. 分子丁是不可能合成的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com