
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A.稀释氨水溶液 10 倍后,其 c(OH-)为原来的![]()
B.pH 之和为 14 的 H2C2O4与 NaOH 溶液混合:c(Na+)+c(H+)=c(OH-)+ c(HC2O4-)
C.pH=5 的 H2S 溶液中,c(H+)=c(HS-)=1×10-5mol/L
D.将等物质的量的Na2CO3 和 NaHCO3 混合溶于水中![]() <1
<1
【答案】D
【解析】
A.一水合氨在稀释过程中继续电离生成OH-,所以稀释氨水溶液10倍后,其c(OH-)大于原来的![]() ,故A错误;
,故A错误;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),所以c(Na+)+c(H+)>c(OH-)+c(HC2O4-),故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)=c(HS-)+2c(S2-)+c(OH-),所以c(H+)>c(HS-),故C错误;
D.Na2CO3的水解程度大于NaHCO3,导致溶液中c(HCO3-)>c(CO32-),则![]() <1,故D正确;
<1,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列有关叙述正确的是( )
①1mol苯乙烯中含有的碳碳双键数为4NA
②6.2g氧化钠和7.8g过氧化钠的混合物中含有的离子总数为0.6NA
③3.4gNH3中含N—H键数目为0.2NA
④常温下1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目相同
⑤常温下4.6gNO2和N2O4混合气体中所含原子总数为3NA
⑥等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1
⑦1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
⑧高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
A. ①④⑦ B. ②⑤⑧ C. ②③④⑥ D. ①②④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B.向 Na2SiO3溶液中通入过量的SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32-
C.由 Na 和 C1 形成离子键的过程:![]()
D.NaHSO4熔融电离:NaHSO4![]() Na++H++SO42-
Na++H++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,元素A有可变化合价。它们之间存在如下图的所示的转化关系。由此推断:
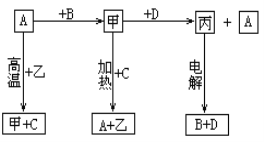
(1)甲的化学式为_____________,丙的化学式为______________。
(2)写出甲和D反应的化学方程式___________________________________________。
(3)为检验化合物甲中元素的化合价,需要用到的药品有_________________________。
A.稀硫酸 B.盐酸 C.硫氰化钾溶液 D.高锰酸钾溶液
(4)为测定A和乙高温反应后所得固体中化合物甲的质量分数。取反应后所得固体并设计以下实验:
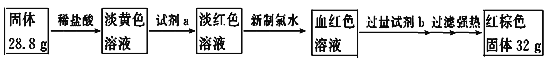
化合物甲的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物F(![]() )是一种用途广泛的试剂,可用作抗氧化剂、香料、医药、农药等。工业上合成它的一种路径如图所示(R1、R2代表烷基):
)是一种用途广泛的试剂,可用作抗氧化剂、香料、医药、农药等。工业上合成它的一种路径如图所示(R1、R2代表烷基):
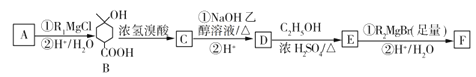
已知:①R'COOC2H5![]()

②![]() (不是羧基)
(不是羧基)![]()
![]()
(1)R2MgBr的化学式为____________,A的结构简式为___________,F的分子式为________。
(2)B中官能团的名称为______________
(3)D到E的反应类型是______________。
(4)写出C与NaOH的乙醇溶液反应的化学方程式:__________。
(5)满足下列条件的D的同分异构体还有_______种。
①与D物质含有相同官能团 ②含有六元环且环上有两个取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含铬废料(主要含 Cr2O3,还含有 FeO、SiO2、Al2O3 等杂质)制备重铬酸钠,实现清洁化工生产,工艺流程如图:
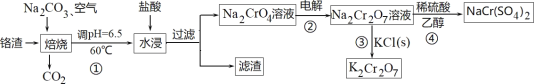
回答下列问题:
(1)焙烧 Cr2O3 转化为Na2CrO4 的化学反应方程式是_____;
(2)实验室模拟此工业流程①,控制反应温度 60℃的方法是_____;
(3)流程②用石墨做电极电解 Na2CrO4 溶液,制备Na2Cr2O7,其原理如图所示,a 是_____极;电极Ⅱ的电极反应式是_____;当生成 2mol Na2Cr2O7时,电路中转移的电子_____mol;
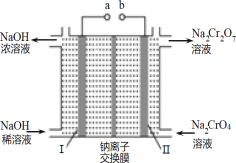
(4)由下图和下表中的溶解度变化,流程③制备 K2Cr2O7,应先充分加热,然后_____反应才能顺利进行;

重铬酸钠的溶解度表:
温度℃ | 10 | 20 | 40 | 60 | 80 | 100 |
溶解度% | 61.6 | 62.8 | 65.1 | 71.8 | 78.7 | 81.1 |
(5)为进一步减少制得的 K2Cr2O7 晶体中 NaCl 等杂质,应再进行_____操作;
(6)流程④Na2Cr2O7 溶液与乙醇反应,乙醇可能被氧化为_____(写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷单质及其化合物有广泛应用。结合所学知识同答下列间题:
(1)磷酸的结构式为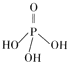 ,二聚磷酸可视为两个磷酸分子之间脱去一个水分子的产物,二聚磷酸钠(俗称“磷酸四钠”)是一种常用的延长混凝土凝结时间的缓凝剂,其化学式为_____。
,二聚磷酸可视为两个磷酸分子之间脱去一个水分子的产物,二聚磷酸钠(俗称“磷酸四钠”)是一种常用的延长混凝土凝结时间的缓凝剂,其化学式为_____。
(2)工业制备PH3的工艺流程如下(部分操作和条件略):
Ⅰ.向黄磷(P4)中加入过量浓NaOH溶液,产生PH3气体和次磷酸钠(NaH2PO2)溶液;
Ⅱ.向NaH2PO2溶液加入过量的稀硫酸,得到次磷酸(H3PO2);
Ⅲ.次磷酸(H3PO2)不稳定,受热易分解产生PH3气体和磷酸(H3PO4)。
①黄磷和烧碱溶液反应的离子方程式为_____,根据题意判断次磷酸属于_____(填“一”“二”或“三”)元酸。
②次磷酸受热分解的化学方程式为_____。
③起始时有1mol P4参加反应,则整个工业流程中共生成_____mol PH3(不考虑产物的损失)。
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性条件下发生下述反应,请配平:
_____Ni2++ H2PO2﹣+ ═ Ni++ H2PO3﹣+ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.按要求写出下列反应的方程式:
(1)钠与水反应的化学方程式:____________
(2)铝与氢氧化钠溶液反应的离子化学方程式:____________
(3)铁与水蒸气反应的化学方程式:____________
Ⅱ.大气污染物主要成分是SO2、NO、CO及可吸入颗粒等,主要来自于燃煤、机动车尾气和工业废气,会导致雾霾、酸雨等。
(1)大气污染物成分中属于酸性氧化物的是___________(填化学式)。
(2)工业上可以用NaOH溶液吸收少量的SO2,生成Na2SO3。写出反应的离子方程式:________。
(3)汽车的三元催化转化器中,在催化剂作用下NO和CO转化为无毒气体,该反应的化学方程式是:____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com