
【题目】关于下列电化学装置说法正确的是

A. 装置①中,构成电解池时Fe极质量既可增也可减
B. 装置②工作一段时间后,a极附近溶液的pH减小
C. 用装置③精炼铜时,d极为精铜
D. 装置④中电子由Fe经导线流向Zn
【答案】A
【解析】
A.铁做阳极时,质量减轻,铁做阴极时,铜离子在此极析出,质量增加;B.氢离子在阴极得电子,生成氢气,氢离子浓度减小,pH增大;C. 精炼铜时,粗铜做阳极;D.电子由负极经过导线流向正极。
如果铁连在电源的正极,做电解池阳极时,失电子,不断溶解,铁极质量减轻,如果铁连在电源的负极,做电解池阴极时,不发生反应,溶液中的铜离子在此极析出,Fe极质量增加,A正确;a极与电源负极相连,作阴极,氢离子在阴极得电子,发生还原反应2H++2e-=H2↑,则a极附近溶液的pH增大,B错误;精炼铜时,粗铜作阳极,与电源正极相连,则d极为粗铜,C错误;装置④为原电池,活泼性:Zn>Fe,则Zn 失电子作负极,电子由Zn流向Fe ,D错误;正确选项A。


科目:高中化学 来源: 题型:
【题目】对于反应Cl2+H2O===HCl+HClO的叙述中正确是( )
A. 属于置换反应B. 属于复分解反应
C. 氯气既是氧化剂又是还原剂D. 反应产物都是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A. 已知2H2(g)+O2(g) =2 H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热△H=-241.8 kJ/mol
B. 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2
C. 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq) = CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1
D. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+566.0 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32- |
实验I :取少量该试液进行如下实验。
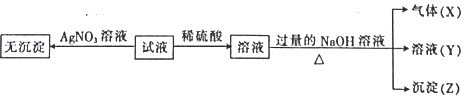
实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol L-l的 NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。

回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___________种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是_____________。检验气体X的方法是______________________;沉淀Z的化学式为_________________。
(3)写出实验Ⅱ的图象中BC段对应的离子方程式:_____________________________________。
(4) A点对应的固体质量为__________g。
(5)通过上述信息,推算该溶液中阴离子的浓度为______________mol L-l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为b g·cm-3,则该盐酸的物的量浓度是( )mol·L-1
A. 1000ab/(22400+36.5a) B. ab/(22400+36.5a)
C. 1000ab/(22.4+36.5a) D. 1000ab/(22400+36.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量分数为a %的氨水与质量分数为b %的氨水等质量混合所得溶液的密度为X1;将质量分数为a %的氨水与质量分数为b %的氨水等体积混合所得溶液的密度为Y1。将质量分数为a % 的硫酸与质量分数为b%的硫酸等质量混合所得溶液的密度为X2;将质量分数为a %的硫酸与质量分数为b%的硫酸等体积混合所得溶液的密度为Y2。则X1、Y1、X2、Y2的大小关系为( )
A. Y2>X2>Y1>X1 B. Y1>X1>Y2>X2 C. Y1>X2>Y2>X1 D. Y2>X2>X1>Y1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①已知t ℃时AgCl的Ksp为2×10-10;②在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A. t ℃时,Ag2CrO4的Ksp为1×10-9
B. 在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C. t ℃时,反应Ag2CrO4(s)+2Cl-(aq) ![]() 2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
D. t ℃时,用0.01 mol·L-1 AgNO3溶液滴定20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1的K2CrO4的混合溶液,CrO42-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制取N2O气体。
(1)连二次硝酸中氮元素的化合价为_______。
(2)常温下,用0.01 mol·L-1的NaOH溶液滴定10 mL 0.01 mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:_________。
②B点时溶液中c(H2N2O2)___ c(N2O22-)(填“>”、“<”或“=”)。
③A点时溶液中c(Na+)___(HN2O22-)+c(N2 O22-)(填“>”、“<”或“=”)。
(3)已知常温下Ksp(Ag2SO4)=1.4×10-5,Ksp(Ag2N2O2)=4.2×10-9。硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中 ____。
____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图虚线框中的装置可用来检验浓硫酸与木炭粉的加热条件下反应产生的所有气体产物,填写下列空白:

(1)如果装装置中①、②、③三部分仪器的连接顺序改为②、①、③,则可以检出的物质是____________;不能检出的物质是____________。
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是____________;不能检出的物质是____________。
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是____________;不能检出的物质是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com