
【题目】某同学按下图所示的装置进行实验。A、B为两种常见金属,它们的硫酸盐可溶于水,当K闭合时,SO42—从右向左通过交换膜移向A极。下列分析正确的是
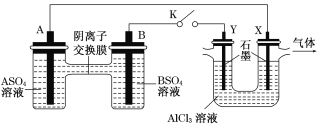
A. 溶液中c(A2+)减小
B. B极的电极反应:B-2e-=B2+
C. Y电极上有H2产生,发生还原反应
D. 反应初期,X电极周围出现白色胶状沉淀
【答案】D
【解析】
A.据右面图示可知,左侧装置为原电池,右侧为电解池。由题意在交换膜处SO42-从右向左移动可知,A为原电池的负极,电极反应式为:A-2e-=A2+, A2+的浓度增大,故A分析错误;
B.B电极为原电池的正极,电极反应式为:B2++2e-=B,故B分析错误;
C.Y电极与原电池的正极B相连,即y电极为电解池的阳极,发生氧化反应,电极反应式为:2Cl一 一2e一=C12↑。故C分析错误;
D.X电极为电解池的阴极,其电极反应式为2H+ + 2e-+ =H2 ↑,由于H+来自于H2O,从而破坏水的电离平衡,使溶液显碱性,所以会发生此反应:AI3++3OH-=Al(OH)3,故D分析正确;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】近年来,我国北京等地出现严重雾霾天气,据研究,雾霾的形成与汽车排放的 CO、 NO2 等有毒气体有关,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气 体,反 应方程式为4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g)ΔH=-1200kJ/mol。对于该反应, 温度不同(T2 > T1 )其他条件相同时,下列图像正确的是
4CO2(g)+N2(g)ΔH=-1200kJ/mol。对于该反应, 温度不同(T2 > T1 )其他条件相同时,下列图像正确的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-a kJ/mol,则a________238.6(填“>”、“<”或“=”)。
(2)反应mA(g)+nB(g)![]() pC(g)+qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g)+qD(g)过程中的能量变化如图所示,回答下列问题。
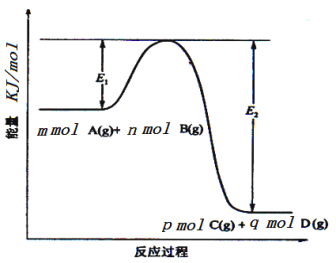
该反应ΔH=_____________________(用含E1、E2式子表示);在反应体系中加入催化剂,E1___________,E2___________(填增大、减小、不变)。
(3)已知常温时红磷比白磷稳定,已知:
①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1
②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2
比较反应中ΔH的大小:ΔH1_______ΔH2(填“>”、“<”或“=”)。
(4)已知:稀溶液中,H+(aq)+OH(aq)=H2O(l) ΔH=﹣57.3 kJ![]() ,则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量________57.3 kJ(填“>”、“<”或“=”)。
,则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量________57.3 kJ(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3 , 还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
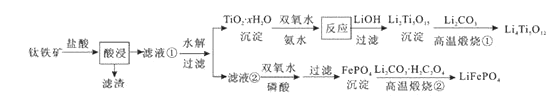
下列说法不正确的是( )
A.“酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C.“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O↑+3CO2↑
2LiFePO4+H2O↑+3CO2↑
D.TiO2 · xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/ ℃ | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | 88 |
可知,40 oC前,未达到平衡状态,随着温度升高,转化率变大;40 oC后,H2O2分解加剧,转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用下列方法制取NH3:
①固体Ca(OH)2与NH4Cl共热。
②NH4HCO3固体中加NaOH固体(过量),常温下即能产生NH3;装置如图。
![]()
③NaOH固体中加入浓氨水。
④NH4Cl浓溶液中加生石灰。
请回答下列问题:
(1)写出②方法制取氨气的化学方程式___________________________。
(2)说明③方法制取氨气的原理:_____________,为什么此法不加热? __________。
(3)请从下面的仪器中选择④方法制取氨气的发生装置________(写字母,要求使用仪器最少、合理)。

写出用NH4Cl浓溶液与生石灰反应制取氨气的理由:__________。

(4)某同学设计了如图装置收集氨气,下列说法不正确的是________(填字母)。
A.收集氨气的原理是向下排空气法
B.干燥管的作用是防止倒吸
C.当烧杯中的水变红时证明氨气已收集满
D.该装置会形成红色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.澄清透明的溶液:K+、H+、SO42-、MnO4-
B.0.1 mol·L-1 NaClO溶液:Na+、NH4+、CO32-、SO32-
C.0.1 mol·L-1 FeCl3溶液:Ba2+、Al3+、SCN-、Cl-
D.![]() =0.1 mol·L-1的溶液:Na+、K+、AlO2-、Br-
=0.1 mol·L-1的溶液:Na+、K+、AlO2-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO、NO2、碳氢化合物等多种污染物。回答下列问题:
(1)已知:2C8H18(1)+25O2(g)=16CO2(g)+18H2O(g) △H1=-10244kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746kJ·mol-1
①若H2O(1)=H2O(g) △H=+44kJ·mol-1,则表示辛烷燃烧热的热化学方程式为______________________________________________。
②部分化学键键能数据如下:
化学键 | O=O | C=O | C≡O |
E/(kJ·mol) | 494 | 799 | 1076 |
△H2=__________kJ·mol-1
(2)1573K时,N2+O2![]() 2NO平衡常数为2. 0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0. 2mol、0. 001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
2NO平衡常数为2. 0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0. 2mol、0. 001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
(3)反应NO(g)+CO(g)=N2(g)+CO2(g)的平衡常数为1. 68×1060,从热力学角度看,该反应程度应该很大,实际汽车尾气中该反应的程度很小,原因是________________,要增大汽车尾气净化装置中单位时间内该反应的程度,关键是要_____________。
(4)T<500K时,反应NO2(g)+CO(g)=NO(g)+CO2(g)分两步进行:
第一步:NO2(g)+NO2(g)→NO3(g)+NO(g) (慢反应)
第二步:NO3(g)+CO(g)→NO(g)+CO2(g) (快反应)
下列表述正确的是__________(填标号)
A. 反应速率与NO浓度有关 B. 反应速率与NO2浓度有关
C. 反应的中间产物只有NO3 D. 第二步反应活化能较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向盛有KI3溶液的试管中加入适量CCl4,振荡后静置,CCl4层显紫色(已知I3- | KI3在CCl4中的溶解度比在水中的大 |
B | 向淀粉溶液中加入稀硫酸水浴加热后,再加入银氨溶液水浴加热,未出现银镜 | 淀粉未发生水解 |
C | 向饱和Na2CO3溶液中加入少量BaSO4粉末搅拌,过滤,向洗净的沉淀中加入稀盐酸,有气体放出 | Ksp(BaSO4)>Ksp(BaCO3) |
D | 向新制饱和氯水中滴加紫色石蕊试液,溶液先变红后褪色 | 氯水具有酸性和漂白性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将盐酸滴加到联氨(N2 H4)的水溶液中,混合溶液中pOH[pOH=- lgc(OH- )]随离子浓度变化的关系如图所示。下列叙述正确的是(已知N2H4在水溶液中的电离方程式:N2H4+H2O- ![]() N2H5++OH- ,N2H5+ +H2O-
N2H5++OH- ,N2H5+ +H2O- ![]() N2H62++OH- )
N2H62++OH- )
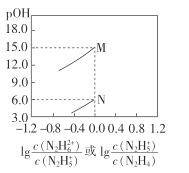
A.联氨的水溶液中不存在H+
B.曲线M表示pOH与![]() 的变化关系
的变化关系
C.反应N2H4+H2O![]() N2H5++OH-的K=10-6
N2H5++OH-的K=10-6
D.N2H5Cl的水溶液呈碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com