
【题目】一定条件下,在容积不变的密闭容器中进行如下反应:NO(g)+ CO(g)![]()
![]() N2(g)+ CO2(g);△H=-373.2 kJ/mol。右图曲线a表示该反应过程中,NO的转化率与反应时间的关系。若改变起始条件,使反应过程按照曲线b进行,可采取的措施是( )
N2(g)+ CO2(g);△H=-373.2 kJ/mol。右图曲线a表示该反应过程中,NO的转化率与反应时间的关系。若改变起始条件,使反应过程按照曲线b进行,可采取的措施是( )
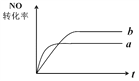
A. 加催化剂 B. 降低温度
C. 增大反应物中NO的浓度 D. 向密闭容器中加入氩气
科目:高中化学 来源: 题型:
【题目】下列关于电解精炼铜的说法中不正确的是
A. 电解质溶液中要含有Cu2+
B. 粗铜作阳极,精铜作阴极
C. 电解时,阳极发生氧化反应,阴极发生还原反应
D. 粗铜中所含Zn、Fe、Ni等杂质电解后以单质形式沉枳于阳极泥中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质。
(1)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) H1=-1160kJ/mol
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) H2=-574kJ/mol
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体。
①该混合气体中NO和NO2的物质的量之比为________;
②在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式:________.
(2)以甲烷为燃料的新型燃料电池,其成本大大低于以氢气为燃料的传统燃料电池,目前已得到了广泛的研究。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。
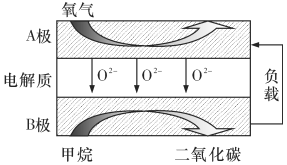
①B极为电池________极,电极反应式为________。
②若用该燃料电池作电源,用石墨作电极电解100mL1mol/L的硫酸铜溶液,写出阳极的电极反应式:_______;标准状况下,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为________,实际上消耗的甲烷体积(已折算成标准状况下)比理论上大,可能原因为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香族化合物A的分子中含有C、H、O.N四种元素,相同状况下,其蒸气的密度是氢气密度的68.5倍。现以苯为原料合成A,并最终制得F(一种染料中间体),转化关系如下图所示(一些非主要产物已略去):
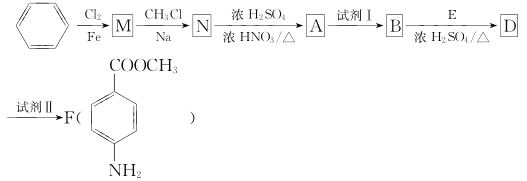
已知:
I.R-Cl+2Na+Cl-R'→R-R'+2NaCl(R、R'为烃基);
Ⅱ. 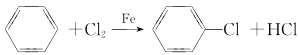
Ⅲ.  (苯胺,弱碱性,易被氧化)。
(苯胺,弱碱性,易被氧化)。
请回答下列问题:
(1)写出A的分子式:_____________。
(2)N→A的反应类型是____________。
(3)上述转化中的试剂Ⅱ是__________(填字母代号)。
a.KMnO4(H+) b.Fe/盐酸 c.NaOH溶液
(4)用核磁共振氢谱可以证明化合物E中含有______种处于不同化学环境的氢。
(5)同时符合下列两个要求的D的同分异构体有_____种。
①属于芳香族化合物,分子中只有两个互为对位的取代基,其中一个取代基是硝基;
②分子中含有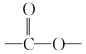 结构。
结构。
其中有一种D的同分异构体W,其在酸性条件下水解后,可得到一种能与FeCl3溶液发生显色反应的产物,写出W在酸性条件下水解的化学方程式:_________________。
(6)F在一定条件下的水解反应如下所示:
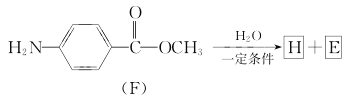
化合物H在一定条件下经缩聚反应可制得高分子纤维,该高分子纤维可广泛应用于通讯、导弹、宇航等领域。请写出该缩聚反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按如图所示装置进行实验(部分夹持仪器及加热装置未画出)。
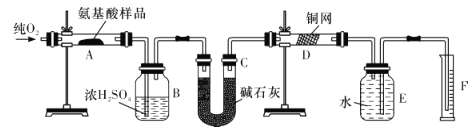
请回答下列有关问题:
(1)在安装E、F装置前,先要通入一段时间的氧气,其理由是_________。
(2)上述装置图中需要加热的仪器有________(填字母代号,下同),操作时应先点燃_____处的酒精灯。
(3)D装置的作用是_______________。
(4)A装置中发生反应的化学方程式是______________。
(5)读取N的体积时,应注意:①__________;②____________。
(6)实验中测得N2的体积为VmL(已折算成标准状况下)。为确定此氨基酸的分子式,还需要的有关数据有______(填字母代号)。
A.生成二氧化碳气体的质量 B.生成水的质量
C.通入氧气的体积 D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制240 mL 0.8 mol·L-1的NaOH溶液,请回答下列问题:
(1)称取NaOH固体______g。
(2)在配制该溶液过程中,需经过称量、溶解、转移溶液、定容等操作,下列图示对应的操作规范是______。根据图示,除称量外还缺少的操作步骤依次是___________、__________。
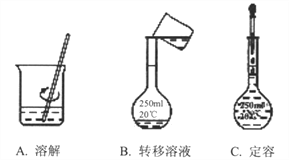
(3)在配制过程中,若其他操作都正确,下列操作会引起NaOH溶液浓度偏低的是__________。
A.称量好的固体放置一段时间后进行溶解操作
B.溶液未冷却至室温即转移到容量瓶中
C.容量瓶水洗后未干燥
D.转移溶液时不慎有少量溶液滴出瓶外
E.定容时不小心有蒸馏水滴出瓶外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计制取SO2并验证其部分性质的实验装置图如下(夹持装置省略),下列叙述正确的是
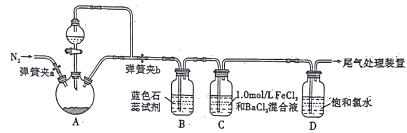
A. 关闭弹簧夹a,打开弹簧夹b,用酒精灯在三颈烧瓶下微热,若能观察到C中长导管口有明显气泡现象,就能判断装置A、B部分气密性良好
B. A装置中比较理想的反应物质是Na2SO3固体和质量分数为10%的硫酸
C. B装置溶液变红色,说明SO2是酸性氧化物;C装置产生白色沉淀的原因为:BaCl2+SO2+H20![]() BaSO3↓+2HC1
BaSO3↓+2HC1
D. 取反应后D溶液少许,滴加品红溶液,红色褪去,不能说明SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]()
![]()
![]() (注:R、R′表示烃基),
(注:R、R′表示烃基),![]() 属于酮类,酮不发生银镜反应。今有如下变化:A(C6H12O2)
属于酮类,酮不发生银镜反应。今有如下变化:A(C6H12O2)![]()
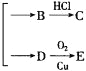 。已知C为羧酸,C、E都不发生银镜反应,则A的结构可能有
。已知C为羧酸,C、E都不发生银镜反应,则A的结构可能有
A. 1种 B. 2种 C. 3种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,浓H2SO4既表现强氧化性又表现酸性的是( )
A. 2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
B. Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
C. S+2H2SO4(浓)![]() 3SO2↑+2H2O
3SO2↑+2H2O
D. Fe2O3+3H2SO4(浓) ===Fe2(SO4)3+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com