
【题目】下列仪器能用酒精灯直接加热的是( )
A.容量瓶B.烧杯C.试管D.烧瓶
科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的叙述正确的是( )
A.溶液呈电中性,部分胶体带电荷,部分胶体不带电荷
B.胶体与其他分散系的本质区别是能否产生丁达尔效应
C.氢氧化铁胶体是一种红褐色的液体
D.胶体是具有一定稳定性的分散剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机物的结构,用核磁共振仪处理后得到如图所示的核磁共振氢谱,则该有机物可能是
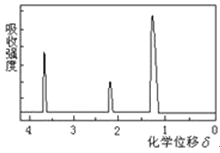
A. C2H5OHB. ![]()
C. CH3CH2CH2COOHD. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图1所示.图2为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同.已知t3~t4阶段为使用催化剂.下列说法错误的是

A. 若t1=15s,生成物C在 t0~t1时间段的平均反应速率为0.004 molL﹣1s﹣1
B. t4~t5阶段改变的条件为减小压强,t5~t6阶段改变的条件是升高化学反应的温度
C. B的起始物质的量为0.02 mol
D. 该化学反应的表达式为:3A(g)B(g)+2C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g) ![]() 4NO2(g)+O2(g)△H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g)△H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)mol/L | 5.00 | 3.53 | 2.50 | 2.50 |
下列说法中不正确的是:
A. T1温度下,500s时O2的浓度为0.74mol/L
B. 平衡后其他件不变,将容器的体积压缩到原来的1/2,则再平衡时c(N2O5)>5.00 mol/L
C. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D. T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长期缺碘和碘摄入过量都会对健康造成危害,目前加碘食盐中碘元素绝大部分以IO3-存在,少量以I-存在。现使用Na2S2O3对某碘盐样品中碘元素的含量进行测定。
I.I-的定性检测
(1)取少量碘盐样品于试管中,加水溶解。滴加硫酸酸化,再滴加数滴5%NaNO2和淀粉的混合溶液。若溶液变________色,则存在I-,同时有无色气体产生并遇空气变红棕色。试写出该反应的离子方程式为 ___________________________________。
Ⅱ.硫代硫酸钠的制备
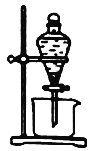
工业制备硫代硫酸钠的反应原理为2Na2S + Na2CO3 +4SO2 =3Na2S2O3 +CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠如下图。

先关闭K1打开K2,打开分液漏斗,缓缓滴浓硫酸,控制好反应速率。
(2)y仪器名称___________ 。此时B装置的作用是___________________________。
(3)反应开始后,C中先有淡黄色浑浊,后又变为澄清,此浑浊物为____________。(填化学式)装置D的作用是____________________________________。
(4)实验结束后,关闭K2打开K1。玻璃液封管x中所盛液体最好为________(填序号)
A.NaOH溶液 B.浓硫酸 C.饱和NaHSO3溶液
Ⅲ.碘含量的测定
巳知:①称取10.00g样品,置于250mL锥形瓶中,加水100mL溶解,加2mL磷酸,摇匀。
②滴加饱和溴水至溶液呈现浅黄色,边滴加边摇,至黄色不褪去为止(约1mL)。
③加热煮沸,除去过量的溴,再继续煮沸5min,立即冷却,加入足量15%碘化钾溶液,摇匀。
④加入少量淀粉溶液作指示剂,再用0.002mol/L的Na2S2O3标准溶液滴定至终点。
⑤重复两次,平均消耗Na2S2O3溶液9.00mL
相关反应为:I-+3Br2+3H2O = IO3-+6H++6Br-
IO3-+5I-+6H+ = 3I2+3H2O
I2+2S2O32-= 2I-+S4O62-
(5)请根据上述数据计算该碘盐含碘量为_______ mg·kg—1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属是不可再生的资源,通过回收废旧的锂电池提取锂、铝、钴等重要的金属具有重大的意义。已知锂电池的正极材料为LiCoO2、炭黑、铝箔及有机粘合剂,下面是回收的工艺流程:

(1)滤液X中通入过量CO2时发生的主要反应的离子方程式为___________
(2)写出酸浸时加入H2SO4、H2O2反应的化学方程式______________________
(3)实验室中萃取分离CoSO4、Li2SO4溶液时需要加入有机物W,若实验过程中使用如图装置,则该装置中存在的主要错误有______________________
(4)已知部分物质的溶解度(g/100gH2O)情况如下表所示:
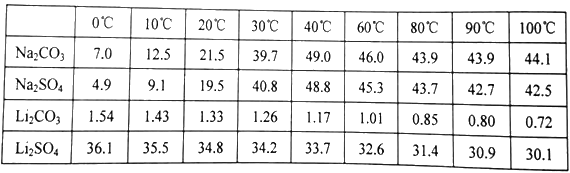
写出浓缩后的溶液中加入饱和碳酸钠溶液的离子反应方程式______________________;为提高Li2CO3的产率,最后过滤实验中需要注意的问题是______________________
(5)若废旧的锂电池拆解后先使用酸溶解,最终也可以得到Al(OH)3、CoSO4、Li2CO3。在酸浸中若Al3+浓度为0.1moL·L-1,则常温时pH>______________________才能够开始形成氢氧化铝沉淀(已知氢氧化铝Ksp=1.3×10-33、lg4.26=0.6、![]() =2.35)
=2.35)
(6)已知100g废旧的锂电池中钴酸锂(LiCoO2)的含量为9.8%,若按照上述生产流程,可以生成2.4gLi2CO3,则其产率为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com