
【题目】现有如下各说法:
①在水中氢、氧原子间的作用力只有共价键。
②金属和非金属化合形成离子键。
③离子键是阳离子、阴离子的相互吸引。
④根据电离方程式HCl=H++Cl-,判断HCl分子里存在离子键。
上述各种说法正确的是( )
A.①②正确B.都不正确
C.④正确,其他不正确D.仅①不正确
科目:高中化学 来源: 题型:
【题目】已知电导率越大导电能力越强。常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定盐酸的曲线
B. 滴定醋酸的过程应该选择甲基橙作为指示剂
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有关物质的溶度积如下
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
下列有关说法不正确的是( )
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg 2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg 2+)∶c(Fe3+)=2 .125×1021
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.054×10-2mol/L],若保持温度不变, 向其中加入100mL 0.012mol/L的NaOH,则该溶液变为不饱和溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”——全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法不正确的是
A.分子中三个碳原子不可能处于同一直线上
B.相同压强下,沸点:C3F8>C3H8
C.全氟丙烷的电子式为: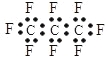
D.全氟丙烷分子中既有极性键又有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关CuCl2溶液的叙述中正确的是
A.溶液中存在自由移动的离子:CuCl2![]() Cu2+ + 2Cl-
Cu2+ + 2Cl-
B.溶液中:c(Cu2+)+c(H+)=c(Cl-)+c(OH-)
C.用惰性电极电解该溶液时,阳极有黄绿色气体产生
D.配制CuCl2溶液时,需加入少量稀硫酸抑制其水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液中大量共存的一组是( )
A.K+、NH![]() 、CO
、CO![]() 、OH-B.Cu2+、Na+、NO
、OH-B.Cu2+、Na+、NO![]() 、Cl-
、Cl-
C.Na+、Ba2+、SO![]() 、I-D.H+、Fe2+、NO
、I-D.H+、Fe2+、NO![]() 、ClO-
、ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取中药药剂As2O3。工艺流程如下:
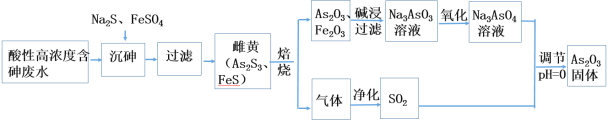
回答下列问题:
(1)已知砷元素与N同一主族,原子比N原子多两个电子层,则砷元素的原子序数为________,“沉砷”中所用Na2S的电子式为_____________。
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是_________________________________。(写名称)
(4)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为:_______________。
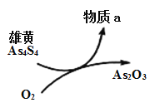
(5)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为___________。(填化学式)
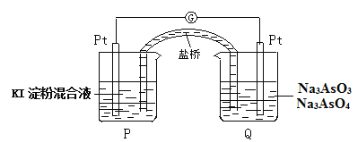
(6)某原电池装置如图,电池总反应为:AsO43-+2I-+H2O![]() AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。
AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用___摄取铁元素的原子光谱。
(2)FeC13的熔点为306℃,沸点为315℃。由此可知FeC13属于____晶体。FeSO4常作净水剂和补铁剂,SO42-的立体构型是____。
(3)铁氰化钾 K3[Fe(CN)6]是检验Fe2+的重要试剂。
①基态N原子的轨道表示式为____。
②写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式_____。
③铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为____。
④铁氰化钾中,不存在___(填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E.金属键
(4)有机金属配位化合物二茂铁[(C5H5)2Fe]是汽油中的抗震剂。分子中的大Π键可用符号![]() 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为![]() ),则
),则![]() 中的大Π键应表示为____,其中碳原子的杂化方式为____。
中的大Π键应表示为____,其中碳原子的杂化方式为____。
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含__mol配位键。
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。其中铁原子周围最近的铁原子个数为___;六棱柱底边长为acm,高为c cm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为____g/cm3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为分析某有机化合物A的结构,进行了如下实验:
(1)向NaHCO3溶液中加入A,有气体放出,说明A中含有___________官能团(写结构简式)。
(2)向NaOH溶液中加入少许A,加热一段时间后,冷却,用HNO3酸化后再滴加AgNO3溶液,产生淡黄色沉淀,说明中A还有___________官能团(写名称)。
(3)经质谱分析,Mr(A)=153,且A中只有四种元素,则A的分子式为___________。
(4)核磁共振氢谱显示,A的氢谱有3种,其强度之比为1︰2︰2,则A结构简式为___________。
(5)已知A可发生如下图所示的转化:
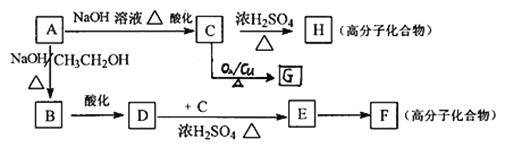
①A→B、D→E的反应类型分别为___________、___________。
②写出下列反应的化学方程式C→H:_________________________。
③C的同分异构体有多种,写出与C具有相同的官能团的C的同分异构体的结构简式:___________________________;写出F的结构简式:________________________。
④G与过量的银氨溶液反应,每生成2.16gAg,消耗G的物质的量是__________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com