
【题目】某有机物的分子结构如图(图中棍表示单键、双键或叁键),它属于烃或烃的含氧衍生物。关于该有机物的叙述正确的是( )
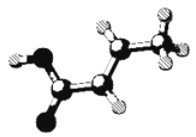
A. 该有机物的化学式为C4H6O B. 该有机物可发生取代反应和加成反应
C. 该有机物可使溴水褪色,但不能与NaOH溶液反应 D. 该有机物是乙酸的同系物
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案科目:高中化学 来源: 题型:
【题目】在25 ℃、101 kPa时,反应能量转化关系如图所示,下列说法不正确的是

已知:C(s)+O2(g)===CO2(g) ΔH1;CO(g)+![]() O2(g)===CO2(g) ΔH2;
O2(g)===CO2(g) ΔH2;
A. ΔH2=-282.9kJ·mol-1
B. 2C(s)+O2(g)===2CO(g) ΔH=-221.2 kJ·mol-1
C. ΔH1>ΔH2
D. CO2(g)分解为C(s)和O2(g)是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:

(1)SO2气体还原Fe3+的产物是________________(填离子符号),参加反应的SO2和Fe3+的物质的量之比是________。
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是__________________________________________________。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有________(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。反应原CH2=CH2(g)+H2O(g)=CH3CH2OH(g )△H。已知几种共价键的键能如下:
化学键 | C-H | C=C | H-O | C-C | C-O |
键能/kJ·mol-1 | 413 | 615 | 463 | 348 | 351 |
下列说法错误的是
A. 上述合成乙醇的反应原子利用率为100%
B. 相同时间段内,用该反应中三种物质表示的该反应的化学反应速率相等
C. 碳碳双键的键能大于碳碳单键键能,但碳碳单键更稳定
D. 上述反应式中,△H=+34kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族元素包括碳、硅、锗(Ge)、锡(Sn)、铅等,它们的单质及化合物广泛应用于我们生活的各个领域。锗和锡以前曾被用于半导体材料,铅被用来制造蓄电池。碳族元素在化合物中只有铅以低价形式存在时较稳定,其它元素在化合物中都是以高价形式存在比较稳定,回答下列问题:
Ⅰ.(1)高岭土的成分中含Al2(Si2O5)(OH)4,请改写成氧化物的形式_________________;
(2)实验室用单质锡粉制取少量二氯化锡溶液,制取和保存的方法是(用文字叙述)___________________;
(3)铅有多种氧化物,写出四氧化三铅与浓盐酸反应的离子方程式_____________________;二氧化铅在空气中强热会得到一系列铅的其它氧化物。若把239g二氧化铅强热,当质量变为231g时,写出反应的化学方程式____________________________。
Ⅱ.CH4–CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
CH4–CO2催化重整反应为:CH4(g)+ CO2(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4 (g) ΔH=–75 kJ·mol1 ①C(s)+O2(g)=CO2(g) ΔH=–394 kJ·mol1②2C(s)+O2 (g)=2CO(g) ΔH=–222kJ·mol1③
(1)有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)若该反应在容积不变的绝热容器中进行,能够判断该反应已达到平衡的是____(填标号)。
A、c(CO2)/c(H2)不再发生变化 B.气体的密度不再发生变化 C.气体的平均摩尔质量不再发生变化 D.每有8molC-H键生成的同时有4molH-H键的断裂 E.容器的温度不再发生变化
(3)T℃时,在体积为10 L的容器中加入10 mol CH4、5 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,此温度下,该反应的化学平衡常数K=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为探究铁和浓硫酸反应的产物及性质,用如图所示装置进行实验![]() 夹持装置和A中加热装置已略,气密性已检验
夹持装置和A中加热装置已略,气密性已检验![]()

实验开始前,先打开弹簧夹通一段时间![]() ,关闭弹簧夹后,在A中滴加一定量的浓硫酸,观察实验现象,然后加热,观察到A中有白雾生成,铁片上有气泡产生.已知A中白雾是硫酸与水形成的酸雾.请回答下列问题:
,关闭弹簧夹后,在A中滴加一定量的浓硫酸,观察实验现象,然后加热,观察到A中有白雾生成,铁片上有气泡产生.已知A中白雾是硫酸与水形成的酸雾.请回答下列问题:
(1)铁片上滴入浓硫酸未加热前没有明显现象的原因是__________________________;
(2)加热一段时间后发现B装置中溶液褪色,取出A中的溶液少许,加入KSCN溶液未出现血红色,写出此时A中反应的化学方程式:_________________________;
(3)C装置的作用是除去二氧化硫气体中硫酸蒸汽,则盛放的溶液是__________________;
A:水 B:NaOH溶液 C: 饱和Na2SO3溶液 D:饱和NaHSO3溶液
(4)实验开始前,先通一段时间N2的目的是___________________________________![]()
(5)可以证明![]() 是弱酸的实验装置是_______________________________
是弱酸的实验装置是_______________________________
(6)E中的现象是_______________________,该现象表明SO2具有______________性![]()
(7)装置F的作用是吸收尾气,写出该装置中反应的化学方程式__________________,以下各种尾气吸收装置中,适合于吸收该尾气,而且能防止倒吸的是______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A. 碳酸钙溶于稀醋酸:CaCO3+2H+=Ca2++H2O+CO2↑
B. 铜与稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
C. 向NH4HCO3溶液中滴加过量Ba(OH)2溶液:HCO3-+OH-+Ba2+=H2O+BaCO3↓
D. 用银氨溶液检验乙醛中的醛基:CH3CHO+[Ag(NH3)2]++2OH- ![]() CH3COO-+NH4++NH3+ Ag↓+H2O
CH3COO-+NH4++NH3+ Ag↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
| 选项 | a | b | c |
A | Al | AlCl3 | Al(OH)3 | |
B | CO2 | Na2CO3 | NaHCO3 | |
C | Si | SiO2 | H2SiO3 | |
D | S | SO3 | H2SO4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应原子利用率最高的是
A. 工业制漂白粉2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
B. 工业制备钠2NaCl(熔融)![]() 2Na+Cl2↑
2Na+Cl2↑
C. 火法炼铜3Cu2S+3O2![]() 6Cu+3SO2
6Cu+3SO2
D. 现代石油工业采用银做催化剂生产环氧乙烷2CH2=CH2→![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com