
【题目】硫化氢气体在资源利用和环境保护等方面均有重要应用。
(1)工业上采用高温分解H2S制取氢气,2H2S(g)![]() 2H2(g)+S2(g),在膜反应器中分离出H2。在容积为2L的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。
2H2(g)+S2(g),在膜反应器中分离出H2。在容积为2L的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。

①反应2H2S(g)![]() 2H2(g)+S2(g)的
2H2(g)+S2(g)的![]() H___________(填“>”“<’或“=”)0。
H___________(填“>”“<’或“=”)0。
②985℃时,反应经过5s达到平衡状态,此时H2S的转化率为40%,则用H2表示的反应速率为v(H2)=____________。
③随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是____________。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如下图所示。
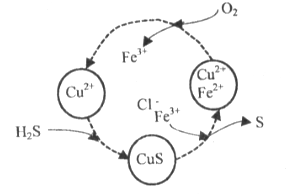
①在图示的转化中,化合价不变的元素是____________。
②在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中尽可能不含CuS,可采取的措施有________。
【答案】> 0.04mol/(L·S) 温度升高,反应速率加快,达到平衡所需时间缩短 ①Cu、Cl、H 增加氧气的通入量或增加起始时c(Fe3+)
【解析】
(1)①由图象可知,随着温度升高,H2S的转化率逐渐增大,说明温度升高时,平衡正向移动,则该反应为吸热方向,即△H>0。
②若985℃时,H2S的转化率为40%,则参加反应的硫化氢为0.4 mol,生成氢气0.4mol,所以氢气的反应速率为v=△c/△t=![]() =0.04 mol/(L·S);
=0.04 mol/(L·S);
③随着温度升高,反应速率逐渐加快,达到平衡所需时间缩短,所以曲线b向曲线a逼近;
(2) ①根据图示可知,整个过程中-2价的S与0价的S之间相互转化,还存在Fe2+与Fe3+之间的相互转化。
②根据图示,可增大空气的量,使S2-完全转化为单质S,使其没有机会和Cu2+结合生成CuS。
(1)①由图象可知,温度升高,转化率增大,则平衡正移,所以正方向为吸热方向,即△H>0,
②H2S的物质的量为1 mol,体积2L,起始浓度为0.5 mol/L,若985℃时,反应经5s达到平衡,此时H2S的转化率为40%,则参加反应的硫化氢为0.5 mol/L×40%=0.2 mol/L,
v=△c/△t=![]() =0.04 mol/(L·S);
=0.04 mol/(L·S);
③随着温度升高,反应速率逐渐加快,达到平衡所需时间缩短,所以曲线b向曲线a逼近;
故答案为:>;0.04mol/(L·s);温度升高,反应速率加快,达到平衡所需时间缩短;
(2)①通过图示可以看出来Fe的化学价由+3变为+2,S的化合价由-2变0价,化合价没有变的元素是Cu、Cl和H三种元素;
②在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有:增加氧气的通入量或增加起始时c(Fe3+)。
故答案为:Cu、Cl、H;增加氧气的通入量或增加起始时c(Fe3+)。


科目:高中化学 来源: 题型:
【题目】下列关于强弱电解质及非电解质的判断完全正确的是
选项 | A | B | C | D |
强电解质 | NaCl | CaCl2 | HNO3 | H2SO4 |
弱电解质 | CH3COOH | BaSO4 | AlCl3 | HF |
非电解质 | Cl2 | CO2 | SO2 | C2H5OH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
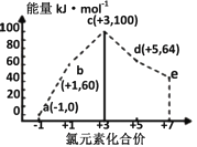
A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为反应物能量减生成物能量
C. b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116 kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量的叙述不正确的是( )
A.物质的量是国际单位制中七个基本物理量之一
B.物质的量是表示物质所含微观粒子多少的一个物理量
C.物质的量常用符号n表示,其单位是摩尔(mol)
D.物质的量可用来表示物质的质量和数量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题,回答下列问题:
(1)我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是 ___________________(填字母)。
A.煤是重要的化工原料,把煤作燃料简单燃烧掉太可惜,应该综合利用
B.煤是发热量很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料实惠
C.煤燃烧时产生大量二氧化硫和烟尘,对环境污染严重
D.通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
(2)乙醇是未来内燃机的首选环保型液体燃料。2.0 g乙醇完全燃烧生成液态水放出59.43 kJ的热量,则乙醇燃烧的热化学方程式为____________________________________________________________。
(3)由于C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJmol1(b>0)的反应中,反应物具有的总能量________(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________(填“放出”或“吸收”)能量才能转化为生成物。
(4)关于用水制取二次能源氢气,以下研究方向不正确的是________________
A.组成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二次能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊催化剂,用于开发廉价能源,以分解水制取氢气
(5)已知下列两个热化学方程式:
A、2H2(g)+O2(g) ===2H2O(l) △H=-571.6 kJmol-1 B、C3H8(g)+5O2(g) ===3CO2(g)+4 H2O(l) △H=-2 220 kJmol-1,其中,能表示燃烧热的热化学方程式为___________(A或B),其燃烧热为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:已知:反应aA(g)+bB(g) ![]() cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
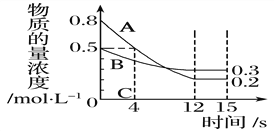
(1)经测定前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为_______________________
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1; 乙:v(B)=0.12 mol·L-1·s-1; 丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为__________________(用甲、乙、丙表示)。
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
氢气体积/mL | 50 | 120 | 224 | 392 | 472 | 502 |
(3)哪一时间段反应速率最大__(填0~1、1~2、2~3、3~4、4~5、5~6 min,下同),原因是_______________________________________________________
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是__________(填字母)
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
Ⅲ:(5)下列说法可以证明H2(g)+I2(g)![]() 2HI(g)已达平衡状态的是______________________
2HI(g)已达平衡状态的是______________________
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=![]() v(HI)
v(HI)
E.温度和体积一定时,容器内压强不再变化
F.温度和体积一定时,混合气体的密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国劳伦斯·利弗摩尔国家实验室(LLNL)设计的以熔融的碳酸盐为电解液,泡沫镍为电极,氧化纤维布为隔膜的直接碳燃料电池结构如图所示,下列说法错误的是( )
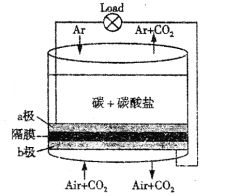
A. a极通气的目的是增强导电能力
B. a极的电极反应式为C+2CO32--4e-=3CO2↑
C. 电流由b极沿导线经负载再流向a极
D. CO32-由b极区透过隔膜流向a极区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com