
【题目】一种用硫酸烧渣(主要成分Fe2O3、FeO、Fe3O4、FeS2、SiO2)制备铵黄铁矾[(NH4)xFey(SO4)z(OH)n,其中Fe为+3价]的工艺流程如下:
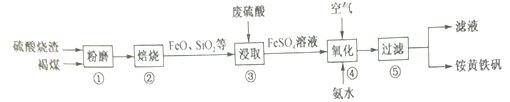
回答下列问题:
(1)焙烧前需进行“粉磨”的目的是_______________;硫酸烧渣加褐煤高温焙烧的主要目的是__________。
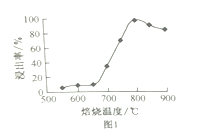
(2)“焙烧”的温度与“浸取”时浸出率的关系如下图1所示,超过800℃时,浸出率开始降低,其原因是缺少_____________________;
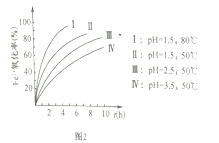
(3)步骤④Fe2+的氧化率随控制条件及时间的变化关系如上图2所示,适宜的条件为 _________选填I、II、III、IV)。从滤液中可回收的产品是________________(填化学式)。
(4)为测定产品铵黄铁矾的化学式,进行以下实验:
步骤1:取19.2 g铵黄铁矾,加足量的稀盐酸溶解,将所得溶液分为A、B两等份;
步骤2:向A中加入足量的NaOH溶液并加热,共收集到0.448L NH3(标准状况下)过滤后将所得滤渣洗涤干燥并灼烧至质量不再变化,可得4 8 g固体残渣;
步骤3:向B中加入足量的BaCl2溶液,过滤洗涤干燥,可得9. 32 g固体残渣。
则产品铵黄铁矾的化学式为_______________。
【答案】 提高焙烧时高价铁的还原率并提高焙烧反应速率 将Fe2O3、Fe3O4还原为FeO并将FeS2转化为FeO,部分FeO与SiO2形成硅酸盐难以浸出 I (NH4)2SO4 NH4Fe3(SO4)2(OH)6
【解析】(1)焙烧前进行“粉磨”,可以增大烧渣与空气的接触面积,提高焙烧时高价铁的还原率并提高焙烧反应速率;硫酸烧渣加褐煤高温焙烧,可以将烧渣中的Fe2O3、Fe3O4还原为FeO并将FeS2转化为FeO,故答案为:提高焙烧时高价铁的还原率并提高焙烧反应速率;将Fe2O3、Fe3O4还原为FeO并将FeS2转化为FeO;
(2)“焙烧”的温度与“浸取”时浸出率的关系如下图1所示,超过800℃时,浸出率开始降低,可能是部分FeO与SiO2形成硅酸盐难以浸出,故答案为:部分FeO与SiO2形成硅酸盐难以浸出;
(3)根据图2,步骤④中Fe2+的氧化率,I>II>III>IV,适宜的条件为I。此时亚铁离子几乎全部被氧化,制得铵黄铁矾,滤液中只存在硫酸铵,故答案为:I;(NH4)2SO4;
(4)步骤1:取19.2 g铵黄铁矾,加足量的稀盐酸溶解,将所得溶液分为A、B两等份;步骤2:向A中加入足量的NaOH溶液并加热,共收集到0.448L NH3(标准状况下),氨气的物质的量为![]() =0.02mol,即含有0.02mol NH4+,质量为0.36g;过滤后将所得滤渣洗涤干燥并灼烧至质量不再变化,可得1 8 g固体残渣,残渣为氧化铁,物质的量为
=0.02mol,即含有0.02mol NH4+,质量为0.36g;过滤后将所得滤渣洗涤干燥并灼烧至质量不再变化,可得1 8 g固体残渣,残渣为氧化铁,物质的量为![]() =0.03mol,即含有0.06mol Fe3+,质量为3.36g;步骤3:向B中加入足量的BaCl2溶液,过滤洗涤干燥,可得9. 32 g固体残渣,该残渣为硫酸钡,物质的量为
=0.03mol,即含有0.06mol Fe3+,质量为3.36g;步骤3:向B中加入足量的BaCl2溶液,过滤洗涤干燥,可得9. 32 g固体残渣,该残渣为硫酸钡,物质的量为![]() =0.04mol,即含有0.04mol SO42-,质量为3.84g;根据上述分析,每份铵黄铁矾中含有的OH-的质量为
=0.04mol,即含有0.04mol SO42-,质量为3.84g;根据上述分析,每份铵黄铁矾中含有的OH-的质量为![]() -0.36g -3.36g -3.84g=2.04g,物质的量为
-0.36g -3.36g -3.84g=2.04g,物质的量为![]() =0.12mol,铵黄铁矾中n(NH4+):n(Fe3+):n(SO42-):n(OH-)=0.02mol: 0.06mol: 0.04mol: 0.12mol=1:3:2:6,因此铵黄铁矾的化学式为NH4Fe3(SO4)2(OH)6,故答案为:NH4Fe3(SO4)2(OH)6。
=0.12mol,铵黄铁矾中n(NH4+):n(Fe3+):n(SO42-):n(OH-)=0.02mol: 0.06mol: 0.04mol: 0.12mol=1:3:2:6,因此铵黄铁矾的化学式为NH4Fe3(SO4)2(OH)6,故答案为:NH4Fe3(SO4)2(OH)6。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列物质性质与应用对应关系正确的是 ( )
A. 晶体硅熔点高、硬度大,可用于制作半导体材料
B. 氢氧化铝具有弱碱性,可用于制胃酸中和剂
C. 漂白粉在空气中不稳定,可用于漂白纸张
D. 氧化铁能与酸反应,可用于制作红色涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为含三种元素的钠盐,其水溶液显碱性.C为大理石的主要成分,请填空: 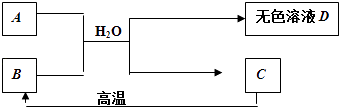
(1)C的化学式 .
(2)D中一定含有的溶质是 . 理由是(用化学方程式表示) .
(3)B用作食品干燥剂的原理: . (用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的乙烯的方法是:
A. 在空气中燃烧 B. 通入足量溴水中
C. 通入酸性高锰酸钾溶液中 D. 通入水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 原子半径大小:Na>S>O B. 金属性强弱: K> Na>Ca
C. 酸性强弱:HIO4>HBrO4>HClO4 D. 碱性强弱:LiOH >NaOH>KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小雨对爸爸给患病的奶奶购买的“便携式制氧器”(图1)产生浓厚的兴趣,他仔细阅读使用说明书,了解了它的工作原理(如图2)和所用的药品.药品中甲剂是一种白色颗粒状固体,作制氧剂;乙剂是黑色固体,作催化剂. 
【提出问题】甲剂的化学成分是什么?
【阅资料】过碳酸钠是白色颗粒状固体,溶于水时,生成碳酸钠和过氧化氢,可用于制取氧气.
【设计与实验】小雨把甲剂和乙剂带到实验室与黄老师共同探究.在老师的指导下,验证出甲剂是一种钠盐后,小雨接着进行如下实验:
[实验一]用甲剂和乙剂制取并验证氧气.
(1)根据图2得出:组装气体发生装置时应选择图3所示的仪器:(填字母),该装置还可用于制取的气体是; 
(2)装置连接完毕,装药品前应先检查装置的;
(3)小雨认为氧气是由过氧化氢在乙剂催化下产生的,其化学方程式为;
(4)检验氧气的方法是 . [实验二]检验上述反应后的溶液中是否含有碳酸根离子.
检验步骤 | 实验操作 | 实验现象 | 结论 | |
步骤一 | 取少量反应后的溶液,加入稀盐酸 | 有气泡产生 | ||
步骤二 | 将步骤一产生的气体通入澄清石灰水 | 澄清石灰水变浑浊 |
(5)【实验结论】通过上述实验,小雨得出甲剂是过碳酸钠. 【反思与评价】小方认为小雨的结论不够严密,你认为严密的结论应该是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:

(1)该反应的化学平衡常数表达式为 ______ ;
(2)根据如图,计算从反应开始到平衡时(4分钟末),平均反应速率v(N2)= ______ .
(3)该反应达到平衡状态的标志是 ______ (填字母);
a.N2和NH3浓度相等
b.NH3百分含量保持不变
c.容器中气体的压强不变
d.3v正(H2)=2v逆(NH3)
e.容器中混合气体的密度保持不变
(4)在第5分钟末改变某一条件后,在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol/L),达到新平衡时NH3浓度的变化曲线如上图.则第5分钟末改变的条件是 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物用途的叙述中,错误的是( )
A.硅可用于制作太阳能电池B.二氧化硅可用于制作计算机芯片
C.硅胶可用作袋装食品的干燥剂D.硅酸钠可用于制备木材防火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中可以大量共存的一组是 ( )
A.H+ Na+ OH-B.Na+ NO3- Cl-
C.K+ H+ HCO3-D.Ca2+ SO42- CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com