
【题目】下列物质性质与应用对应关系正确的是 ( )
A. 晶体硅熔点高、硬度大,可用于制作半导体材料
B. 氢氧化铝具有弱碱性,可用于制胃酸中和剂
C. 漂白粉在空气中不稳定,可用于漂白纸张
D. 氧化铁能与酸反应,可用于制作红色涂料
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是( )
A. 原子半径:Cl>S>O B. 还原性:Na>Mg>Al
C. 稳定性:HF>HCl>HBr D. 酸性:HClO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)广泛用于农药、医药及阻燃剂的生产工业等,工业制备三氯氧磷的过程中会产生副产品亚磷酸(H3PO3)。
(1)三氯氧磷可通过氯化水解法制备,由三氯化磷、水、氯气加热反应生成,则该反应中另一产物的化学式为____________。
(2)已知H3PO3为二元弱酸。某温度下,0.1 mol·L-1的H3PO3溶液中c(H+) = 2.5×10-2 mol·L-1。则该温度下H3PO3的第一步电离的平衡常数Ka1=_______(H3PO3的第二步电离忽略不计,保留两位有效数字)。
(3)亚磷酸具有强还原性,可将Cu2+还原为金属单质,亚磷酸与硫酸铜溶液反应的化学方程式为_____________________。
(4)工业上生产三氯氧磷的同时会产生含磷废水(主要成分为H3PO4、H3PO3)。向废水中先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中 c(PO43-)=4×10-7 mol·L-1,则溶液中c(Ca2+)=___________mol·L-1。{已知Ksp=[Ca3(PO4)2]=2×10-29 }
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为![]() ,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的有( )
,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的有( )
①![]() ②
②![]() ③上述溶液中加入V mL水后,所得溶液的质量分数大于0.5ω ④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
③上述溶液中加入V mL水后,所得溶液的质量分数大于0.5ω ④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
A. ②③ B. ②④ C. ③④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的说法错误的是 ( )
A. 热稳定性:HCl>HI B. 原子半径:Na>Mg
C. 酸性:H2SO3>H2SO4 D. 结合质子能力:S2->Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.聚乙烯没有固定的熔、沸点
B.官能团相同,有机物类别一定相同
C.具有相同通式的有机物一定互为同系物
D.相对分子量相差14的有机物一定互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在原子的第n电子层中,当n为最外层时,最多容纳电子数与(n-1)层相同;当n为次外层时,其最多容纳的电子数比(n-1)层最多容纳的电子数多10,则n层是( )
A. N层 B. M层 C. L层 D. K层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物的酸性由强到弱排列正确的是
A.碳酸、甲酸、乙酸、苯酚B.乙酸、甲酸、碳酸、苯酚
C.甲酸、碳酸、乙酸、苯酚D.甲酸、乙酸、碳酸、苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用硫酸烧渣(主要成分Fe2O3、FeO、Fe3O4、FeS2、SiO2)制备铵黄铁矾[(NH4)xFey(SO4)z(OH)n,其中Fe为+3价]的工艺流程如下:
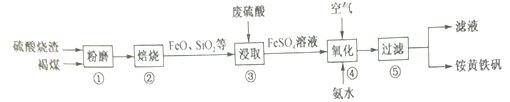
回答下列问题:
(1)焙烧前需进行“粉磨”的目的是_______________;硫酸烧渣加褐煤高温焙烧的主要目的是__________。
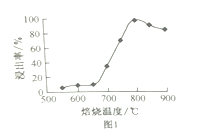
(2)“焙烧”的温度与“浸取”时浸出率的关系如下图1所示,超过800℃时,浸出率开始降低,其原因是缺少_____________________;
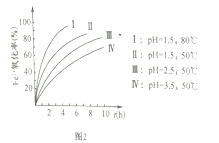
(3)步骤④Fe2+的氧化率随控制条件及时间的变化关系如上图2所示,适宜的条件为 _________选填I、II、III、IV)。从滤液中可回收的产品是________________(填化学式)。
(4)为测定产品铵黄铁矾的化学式,进行以下实验:
步骤1:取19.2 g铵黄铁矾,加足量的稀盐酸溶解,将所得溶液分为A、B两等份;
步骤2:向A中加入足量的NaOH溶液并加热,共收集到0.448L NH3(标准状况下)过滤后将所得滤渣洗涤干燥并灼烧至质量不再变化,可得4 8 g固体残渣;
步骤3:向B中加入足量的BaCl2溶液,过滤洗涤干燥,可得9. 32 g固体残渣。
则产品铵黄铁矾的化学式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com