
【题目】A为含三种元素的钠盐,其水溶液显碱性.C为大理石的主要成分,请填空: 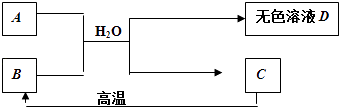
(1)C的化学式 .
(2)D中一定含有的溶质是 . 理由是(用化学方程式表示) .
(3)B用作食品干燥剂的原理: . (用化学方程式表示)
【答案】
(1)CaCO3
(2)氢氧化钠;Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
(3)CaO+H2O=Ca(OH)2
【解析】解:C为大理石的主要成分,则C为CaCO3 , A为含三种元素的钠盐,其水溶液显碱性,CaCO3高温分解得B,B与A在水中反应生成C,则B为CaO,A为Na2CO3 , 无色溶液D为氢氧化钠,氧化钙与水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成氢氧化钠和碳酸钙,符合各物质转化关系,(1)根据上面的分析可知,C的化学式为CaCO3 , 所以答案是:CaCO3; (2)根据上面的分析可知,D中一定含有的溶质是氢氧化钠,反应的化学方程为 Ca(OH)2+Na2CO3=2NaOH+CaCO3↓,
所以答案是:氢氧化钠; Ca(OH)2+Na2CO3=2NaOH+CaCO3↓;(3)B为CaO,B能吸收水生成氢氧化钙,所以可以用作食品干燥剂,涉及的化学方程式为CaO+H2O=Ca(OH)2 ,
所以答案是:CaO+H2O=Ca(OH)2 .


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)广泛用于农药、医药及阻燃剂的生产工业等,工业制备三氯氧磷的过程中会产生副产品亚磷酸(H3PO3)。
(1)三氯氧磷可通过氯化水解法制备,由三氯化磷、水、氯气加热反应生成,则该反应中另一产物的化学式为____________。
(2)已知H3PO3为二元弱酸。某温度下,0.1 mol·L-1的H3PO3溶液中c(H+) = 2.5×10-2 mol·L-1。则该温度下H3PO3的第一步电离的平衡常数Ka1=_______(H3PO3的第二步电离忽略不计,保留两位有效数字)。
(3)亚磷酸具有强还原性,可将Cu2+还原为金属单质,亚磷酸与硫酸铜溶液反应的化学方程式为_____________________。
(4)工业上生产三氯氧磷的同时会产生含磷废水(主要成分为H3PO4、H3PO3)。向废水中先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中 c(PO43-)=4×10-7 mol·L-1,则溶液中c(Ca2+)=___________mol·L-1。{已知Ksp=[Ca3(PO4)2]=2×10-29 }
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在原子的第n电子层中,当n为最外层时,最多容纳电子数与(n-1)层相同;当n为次外层时,其最多容纳的电子数比(n-1)层最多容纳的电子数多10,则n层是( )
A. N层 B. M层 C. L层 D. K层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物的酸性由强到弱排列正确的是
A.碳酸、甲酸、乙酸、苯酚B.乙酸、甲酸、碳酸、苯酚
C.甲酸、碳酸、乙酸、苯酚D.甲酸、乙酸、碳酸、苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,几种酸的电离平衡常数如下:
化学式 | HCOOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)上述三种弱酸中,酸性最强的是______________________________(填化学式),其电离方程式为_____________________________________________,电离平衡常数表达式K=_________。
(2)写出H2CO3溶液中存在的各种离子的符号:_________________________________。
(3)向Na2CO3溶液中加入足量HClO,有关反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 常温下,加水稀释醋酸,![]() 增大
增大
C. 多元弱酸的酸性主要由第一步电离决定
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )

A. 根据图象无法确定改变温度后平衡移动方向
B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a>c+d
D. 升高温度,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用硫酸烧渣(主要成分Fe2O3、FeO、Fe3O4、FeS2、SiO2)制备铵黄铁矾[(NH4)xFey(SO4)z(OH)n,其中Fe为+3价]的工艺流程如下:
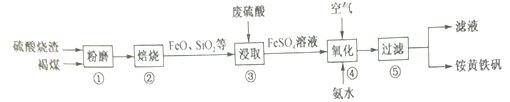
回答下列问题:
(1)焙烧前需进行“粉磨”的目的是_______________;硫酸烧渣加褐煤高温焙烧的主要目的是__________。
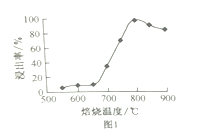
(2)“焙烧”的温度与“浸取”时浸出率的关系如下图1所示,超过800℃时,浸出率开始降低,其原因是缺少_____________________;
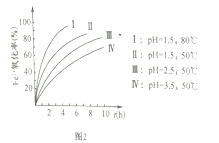
(3)步骤④Fe2+的氧化率随控制条件及时间的变化关系如上图2所示,适宜的条件为 _________选填I、II、III、IV)。从滤液中可回收的产品是________________(填化学式)。
(4)为测定产品铵黄铁矾的化学式,进行以下实验:
步骤1:取19.2 g铵黄铁矾,加足量的稀盐酸溶解,将所得溶液分为A、B两等份;
步骤2:向A中加入足量的NaOH溶液并加热,共收集到0.448L NH3(标准状况下)过滤后将所得滤渣洗涤干燥并灼烧至质量不再变化,可得4 8 g固体残渣;
步骤3:向B中加入足量的BaCl2溶液,过滤洗涤干燥,可得9. 32 g固体残渣。
则产品铵黄铁矾的化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向硝酸钠溶液中加入铜粉不发生反应,若加入某种盐,则铜粉可以逐渐溶解,符合此条件的盐是
A. Na2 SO4 B. NaHCO3 C. NaHSO4 D. FeCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com