
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,并回答下列问题:
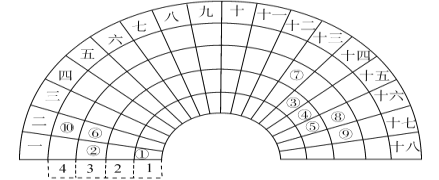
(1)若①~⑩分别代表十种元素,则⑩代表的元素处于常见周期表的位置是_______________________;
(2)⑥⑦为生活中两种常见的金属,其最高价氧化物对应水化物的碱性:⑥____⑦(填>、<或=);比较元素⑧⑨对应的常见单质氧化性的强弱,并用化学方程式证明:____________________________________;
(3)①③⑤三种元素形成的18电子结构化合物是近年来燃料电池研究领域的新宠,写出用它作燃料,②最高价氧化物对应的水化物作为电解质的燃料电池的负极反应式:___________________________;
(4)用电子式表示④的一种10电子结构氢化物的形成过程:_________________________。
【答案】第四周期第IIA族 > 氯气的氧化性大于硫单质,Cl2+ H2S=2HCl+S↓ CH3OH-6e- + 8OH-=CO![]() + 6H2O
+ 6H2O 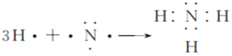
【解析】
由元素在扇形元素周期表中的位置可知:①为第一周期第一列,为H元素、②为第三周期第一列,为Na元素、③为第②周期第十四列,为C元素、则④为N元素、⑤为O元素、⑥为Mg元素、⑦为Al元素、⑧为S元素、⑨为Cl元素、⑩为Ca元素,结合元素周期律分析解答。
根据上述分析可知:①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Ca。
(1)⑩代表的元素为Ca,位于常见元素周期表中第四周期第IIA族,故答案为:第四周期第IIA族;
(2) ⑥为Mg元素、⑦为Al元素,金属性:Mg>Al,其最高价氧化物对应水化物的碱性:⑥>⑦;⑧为S、⑨为Cl,非金属性:S<Cl,对应的常见单质氧化性:S<Cl2,可以用化学方程式证明:Cl2+ H2S=2HCl+S↓,故答案为:>;单质氧化性:S<Cl2,Cl2+ H2S=2HCl+S↓;
(3)①、③、⑤分别代表H、C、O元素,H、C、O三种元素组成的18电子结构的化合物为甲醇,②为Na元素,其最高价氧化物的水化物是氢氧化钠,甲醇碱性燃料电池中,甲醇在负极失去电子,生成的二氧化碳与氢氧根离子结合生成碳酸根离子,负极反应式为:CH3OH-6e-+8OH-=CO![]() +6H2O,故答案为:CH3OH-6e-+8OH-=CO
+6H2O,故答案为:CH3OH-6e-+8OH-=CO![]() +6H2O;
+6H2O;
(4) ④为N元素,N的一种10电子氢化物为NH3,氨气的形成过程用电子式表示为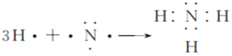 ,故答案为:
,故答案为: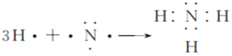 。
。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】I.乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精。为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
①部分物质的沸点:
物质 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
沸点/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
②乳酸乙酯易溶于苯、乙醇;水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发。
该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下:
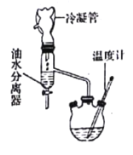
第一步:在反应容器中加入0.1 mol无水乳酸、45.0 mL(密度:0.789g/cm3)无水乙醇、一定量的苯和沸石……;装上油水分离器和冷凝管,缓慢加热回流2 h至反应完全。
第二步:将反应容器中液体倒入盛有适量5%Na2CO3溶液的烧杯中,搅拌并分出有机相后,再用水洗。
第三步:将无水CaCl2加入到水洗后的产品中充分静置,过滤、蒸馏,得产品7.08 g。
(1)第一步操作中,还缺少的试剂是______________________;加入苯的目的是_________________;实验过程中,若油水分离器中水层不再增厚,则表明___________________________________。
(2)第二步中证明“水洗”已经完成的实验方案是_______________________________ 。
(3)本实验制备乳酸乙酯的产率为_________________________。
Ⅱ.磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强,易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05m·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:
(操作流程)安装吸收装置![]() PH3的产生与吸收
PH3的产生与吸收![]() 转移KMnO4吸收溶液
转移KMnO4吸收溶液![]() 亚硫酸钠标准溶液滴定。
亚硫酸钠标准溶液滴定。
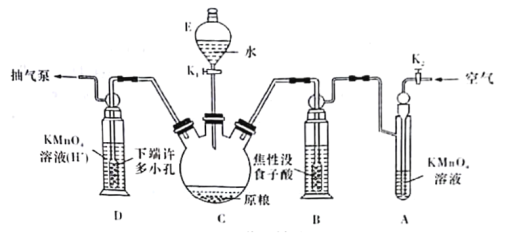
(实验装置)C中盛100 g原粮,D中盛有20.00mL 1.12×10-4 mol·L-1KMnO4溶液(H2SO4酸化)。请回答下列问题:
(4)仪器C的名称是______________;检查整套装置气密性的方法是___________________________________________________________________________。
(5)A中盛装KMnO4,溶液的作用是除去空气中的还原性气体;B中盛装焦性没食子酸的碱性溶液.其作用是______________________________。D中PH3被氧化成磷酸,所发生反应的离子方程式为____________________________________________。
(6)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5 mol·L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗标准Na2SO3溶液11.00 mL,则该原粮中磷化物(以PH3计)的含量为_________________________mg·kg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质X在一定条件下可转化为物质Y或物质Z:
![]()
![]()
两个反应的能量变化如图所示,下列说法正确的是
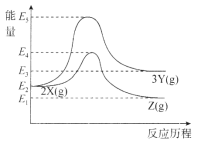
A.两个反应均为放热反应
B.X、Y、Z的关系是互为同素异形体或同分异构体
C.X转化为Y的活化能高于X转化为Z的活化能
D.其它条件一定,加压有利于提高X转化为Z的速率和平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是用途最广泛的基本有机原料,可用于生产塑料、合成橡胶等产品。工业上可用乙烷、二氧化碳、甲醇、乙醇等为原料制乙烯。请回答下列相关问题。
(1)已知H2、C2H4、C2H6的燃烧热依次是286kJ/mol、1411kJ/mol、1560kJ/mol,乙烷热裂解制乙烯的热化学方程式是![]() ,则
,则![]() =_______________。
=_______________。
(2)工业上用乙烷热裂解制乙烯时,通常会在保持起始压强不变的情况下用水蒸气对乙烷稀释以提高平衡转化率,其原理是______________________________________________。
向温度为1015K、体积为5L的刚性容器中充入0.03mol水蒸气和0.06mol乙烷,起始压强为0.15MPa,30s后体系达到平衡,乙烷的平衡转化率为60%,则建立平衡的过程中平均反应速率v(H2)=______________mol/(L·s),![]() 的平衡常数KP=_______________MPa。
的平衡常数KP=_______________MPa。
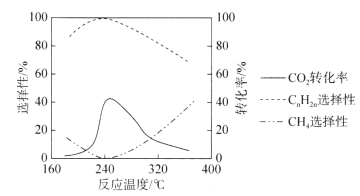
(3)二氧化碳的资源化是目前的热门研究领域,在催化剂的作用下二氧化碳可以和氢气发生反应生成甲烷和低级烯烃CnH2n(n=2~4)。其它条件一定时,反应温度对CO2转化率、CH4选择性、CnH2n选择性的影响如下图所示,从生产低级烯烃的角度考虑,最合适的反应温度是___________。资料显示原料气中![]() 时,随着
时,随着![]() 的增大,低级烯烃的选择性会逐渐降低,但氢气的总转化率不发生明显变化,原因可能是_____________________________________________________________________。
的增大,低级烯烃的选择性会逐渐降低,但氢气的总转化率不发生明显变化,原因可能是_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)除去粗盐中杂质(Mg2+、SO![]() 、Ca2+ ),加入的药品顺序正确的是______ ( 填字母);
、Ca2+ ),加入的药品顺序正确的是______ ( 填字母);
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)制备钠单质的方法之一是将熔融NaCl进行电解,写出电解化学方程式:________________;
(3)步骤I中已获得Br2,步骤I中又将Br2还原为Br- ,其目的是_________________,写出步骤II中发生反应的化学方程式:_______________________;
(4)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:

①图中仪器B的名称是_________________________________;
②C中收集到液体的颜色为__________________________________;
③Br2被过量Na2CO3溶液吸收的氧化产物为NaBrO3,则D中发生反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生活中或实验中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验原理:电极(______、______)、________、________、稀硫酸、耳机(或者电流计)。(请在空格中填写所缺的实验用品)
(3)实验装置(如图)。
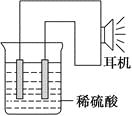
(4)原电池设计及注意的问题:
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓……”的声音。其原因是:在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的________极,电极反应是_____________________________,发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是 ( )
A. 常温常压下,0.05 NA个CO2分子所占的体积是1.12 L
B. 1 mol氧气含有氧原子数为NA
C. 常温常压下,32g氧气和34 g H2S分子个数比为1∶1
D. 标准状况下,NA个水分子所占的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 可用于工业上制备 Na2S2O3。下列化学用语表示正确的是
A.中子数为20的硫原子:![]() S
S
B.Na+的结构示意图: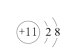
C.Na2S的电子式:![]()
D.CO32-水解的离子方程式 CO32-+2H2O=H2CO3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是
A. 12 g金刚石中含有化学键的数目为4NA
B. 18 g的D2O中含有的质子数为10
C. 28 g的乙烯和环已烷混合气体中所含原子总数为6NA
D. 1 L 1mol·L1的NH4Cl溶液中NH4+和Cl―的数目均为1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com