
【题目】乙烯是用途最广泛的基本有机原料,可用于生产塑料、合成橡胶等产品。工业上可用乙烷、二氧化碳、甲醇、乙醇等为原料制乙烯。请回答下列相关问题。
(1)已知H2、C2H4、C2H6的燃烧热依次是286kJ/mol、1411kJ/mol、1560kJ/mol,乙烷热裂解制乙烯的热化学方程式是![]() ,则
,则![]() =_______________。
=_______________。
(2)工业上用乙烷热裂解制乙烯时,通常会在保持起始压强不变的情况下用水蒸气对乙烷稀释以提高平衡转化率,其原理是______________________________________________。
向温度为1015K、体积为5L的刚性容器中充入0.03mol水蒸气和0.06mol乙烷,起始压强为0.15MPa,30s后体系达到平衡,乙烷的平衡转化率为60%,则建立平衡的过程中平均反应速率v(H2)=______________mol/(L·s),![]() 的平衡常数KP=_______________MPa。
的平衡常数KP=_______________MPa。
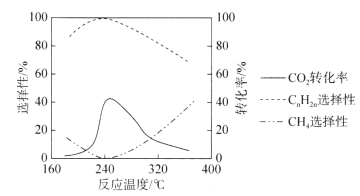
(3)二氧化碳的资源化是目前的热门研究领域,在催化剂的作用下二氧化碳可以和氢气发生反应生成甲烷和低级烯烃CnH2n(n=2~4)。其它条件一定时,反应温度对CO2转化率、CH4选择性、CnH2n选择性的影响如下图所示,从生产低级烯烃的角度考虑,最合适的反应温度是___________。资料显示原料气中![]() 时,随着
时,随着![]() 的增大,低级烯烃的选择性会逐渐降低,但氢气的总转化率不发生明显变化,原因可能是_____________________________________________________________________。
的增大,低级烯烃的选择性会逐渐降低,但氢气的总转化率不发生明显变化,原因可能是_____________________________________________________________________。
【答案】![]() 用水蒸气对原料气进行稀释相当于减压,热裂解反应平衡正向移动,平衡转化率增大(答案合理即可)
用水蒸气对原料气进行稀释相当于减压,热裂解反应平衡正向移动,平衡转化率增大(答案合理即可) ![]() 0.09 240℃ 低级烯烃与氢气发生加成反应生成烷烃
0.09 240℃ 低级烯烃与氢气发生加成反应生成烷烃
【解析】
(1)依据盖斯定律计算可得;
(2)热裂解反应是气体体积增大的反应,用水蒸气对原料气进行稀释相当于减压;依据速率公式和分压平衡常数计算可得;
(3)由图可知,240℃时,二氧化碳转化率和低级烯烃选择性最高,甲烷选择性最低;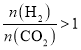 时,随着
时,随着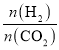 的增大,低级烯烃的选择性逐渐降低,说明生成的烯烃比例减少,氢气的总转化率不发生明显变化说明氢气发生了其它反应,可能是烯烃与氢气发生加成反应生成了烷烃。
的增大,低级烯烃的选择性逐渐降低,说明生成的烯烃比例减少,氢气的总转化率不发生明显变化说明氢气发生了其它反应,可能是烯烃与氢气发生加成反应生成了烷烃。
(1)根据![]() 的燃烧热可得如下热化学方程式:
的燃烧热可得如下热化学方程式:
①![]()
②![]()
③![]()
根据盖斯定律,③—①—②可得乙烷热裂解制乙烯的热化学方程式是![]() ,则
,则![]() ,故答案为:
,故答案为:![]() ;
;
(2)热裂解反应是气体体积增大的反应,用水蒸气对原料气进行稀释相当于减压,热裂解反应平衡正向移动,因此平衡转化率增大;由化学计量数之比等于化学反应速率之比可得
![]() ;容器中起始总物质的量为
;容器中起始总物质的量为![]() ,压强为
,压强为![]() ,根据题中数据可知,平衡时乙烷、乙烯、氢气的物质的量依次为0.06mol—0.06mol×60%=0.024mol,0.06mol×60%=0.036mol,0.06mol×60%=0.036mol,此时容器中总物质的量为(0.024mol+0.036mol+0.036mol+0.03mol)=0.126mol,由
,根据题中数据可知,平衡时乙烷、乙烯、氢气的物质的量依次为0.06mol—0.06mol×60%=0.024mol,0.06mol×60%=0.036mol,0.06mol×60%=0.036mol,此时容器中总物质的量为(0.024mol+0.036mol+0.036mol+0.03mol)=0.126mol,由![]() 可得平衡时压强为
可得平衡时压强为![]() ,则乙烷、乙烯、氢气的平衡分压依次为
,则乙烷、乙烯、氢气的平衡分压依次为![]() ,
,![]() ,故答案为:0.09;
,故答案为:0.09;
(3)由图可知,240℃时,二氧化碳转化率和低级烯烃选择性最高,甲烷选择性最低,因此应选择240℃;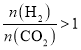 时,随着
时,随着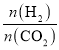 的增大,低级烯烃的选择性逐渐降低,说明生成的烯烃比例减少,氢气的总转化率不发生明显变化说明氢气发生了其它反应,可能是烯烃与氢气发生加成反应生成了烷烃,故答案为:240℃;低级烯烃与氢气发生加成反应生成烷烃。
的增大,低级烯烃的选择性逐渐降低,说明生成的烯烃比例减少,氢气的总转化率不发生明显变化说明氢气发生了其它反应,可能是烯烃与氢气发生加成反应生成了烷烃,故答案为:240℃;低级烯烃与氢气发生加成反应生成烷烃。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】镁稀土合金广泛应用于航空、航天、电子、通讯和汽车制造业等领域。熔盐电解法是一种高效制备镁稀土合金的方法,实验室制取Mg-Gd合金(物质的量比为1:1)的电解槽示意图如下(相对原子质量Mg—24,Gd—157),下列说法正确的是

A.添加LiF、BaF2的作用是催化剂
B.阳极的电极反应式为2F——2e—= F2 ↑
C.当电路中通过0.1mol电子时,生成Mg- Gd合金的质量为3.62 g
D.电解结束后,铝、碳电极质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
A.非金属性强弱: Z> Y
B.气态氢化物的稳定性: Y>Z
C.最高价氧化物的水化物酸性: Y>Z
D.常压下X的单质化学性质非常活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
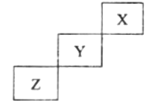
【题目】常温下向10mL0.1mol/L的NaCN溶液中滴加等浓度的盐酸(忽略体积和温度变化),δ(HCN)和![]() 随溶液pH变化的图像如图所示,下列说法错误的是
随溶液pH变化的图像如图所示,下列说法错误的是
A.常温下HCN的电离常数为l0-9.2
B.pH为9.2时,加入盐酸的体积大于5mL
C.pH为a时溶液中c(Cl-)大于pH为b时溶液中c(Cl-)
D.滴加过程中可能出现:c(Na+)>c(CN-)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
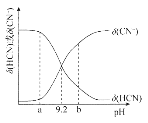
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。
下列说法正确的是
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1 mol/L Z的氢化物的水溶液中c(H+ )=0.1 mol/L,且Z与Y位于不同周期。下列叙述正确的是
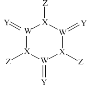
A.原子半径:W> X> YB.氢化物的沸点:Y >X> Z> W
C.X的氧化物的水化物是强酸D.Y的单质均具有杀菌消毒作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,并回答下列问题:
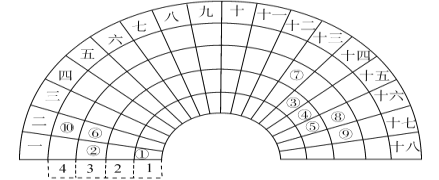
(1)若①~⑩分别代表十种元素,则⑩代表的元素处于常见周期表的位置是_______________________;
(2)⑥⑦为生活中两种常见的金属,其最高价氧化物对应水化物的碱性:⑥____⑦(填>、<或=);比较元素⑧⑨对应的常见单质氧化性的强弱,并用化学方程式证明:____________________________________;
(3)①③⑤三种元素形成的18电子结构化合物是近年来燃料电池研究领域的新宠,写出用它作燃料,②最高价氧化物对应的水化物作为电解质的燃料电池的负极反应式:___________________________;
(4)用电子式表示④的一种10电子结构氢化物的形成过程:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 电池可用于驱动无人潜航器。该电池以海水为电解质溶液,如图所示。该电池工作时,下列说法正确的是 ( )
电池可用于驱动无人潜航器。该电池以海水为电解质溶液,如图所示。该电池工作时,下列说法正确的是 ( )
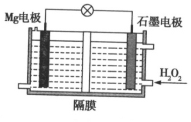
A.电池总反应是![]()
![]()
![]()
B.![]() 在石墨电极上反应放出氧气
在石墨电极上反应放出氧气
C.石墨电极附近溶液的pH增大
D.溶液中![]() 向正极移动
向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是:600℃ 时,在2L密闭容器里A、B、C三种气体在密闭容器中反应时浓度的变化,其中A为有色气体,B、C是无色气体。请从图中分析并填空:
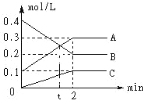
(1)该反应的化学反应方程式为_____
(2)反应达到平衡状态时,反应物的转化率为_____
(3)当反应进行到第_____min,该反应达到平衡。
(4)反应从开始至2分钟末,B的物质的量_____,用B的浓度变化表示的平均反应速率为v(B)=_
(5)下列描述能表示反应达平衡状态的是_____(填选项)。
a.容器中A与B的物质的量相等
b.容器内气体的颜色不再改变
c.各物质的浓度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com