
【题目】短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
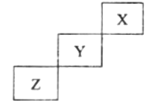
A.非金属性强弱: Z> Y
B.气态氢化物的稳定性: Y>Z
C.最高价氧化物的水化物酸性: Y>Z
D.常压下X的单质化学性质非常活泼
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】氯磺酸(HSO3Cl)在糖精、磺胺药的生产中有重要的应用。常温常压下氯磺酸为无色油状液体,沸点约为152℃,吸湿性和腐蚀性极强,在空气中发烟。学习小组在实验室用SO3和HCl来制备HSO3Cl并测定产品纯度。设计如下实验(夹持装置略去)。请回答下列问题:
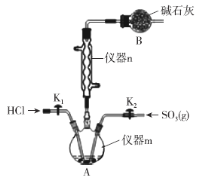
(1)仪器m的名称为___。
(2)已知:HSO3Cl中硫元素为+6价,O原子和Cl原子的最外层均满足8电子稳定结构,则HSO3Cl中的化学键为___ (填“离子键”、“极性键”或“非极性键”)。
(3)SO3可由五氧化二磷与浓硫酸共热制备,发生反应的化学方程式为___。
(4)装置B的作用为___。由仪器n可知制备HSO3Cl的反应为___ (填“放热反应”或“吸热反应”)。
(5)HSO3Cl纯度的测定(仪器m中得到的HSO3Cl中常溶有少量的SO3):
i.取25.0g产品溶于水中,加入过量的Ba(NO3)2溶液充分反应后,过滤。
ii.向滤液中加入过量的AgNO3溶液,过滤、洗涤、干燥、称量,测量所得沉淀AgCl的质量为28.7g。
①HSO3Cl遇水发生反应的化学方程式为___。
②产品HSO3Cl的纯度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精。为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
①部分物质的沸点:
物质 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
沸点/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
②乳酸乙酯易溶于苯、乙醇;水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发。
该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下:
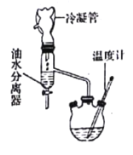
第一步:在反应容器中加入0.1 mol无水乳酸、45.0 mL(密度:0.789g/cm3)无水乙醇、一定量的苯和沸石……;装上油水分离器和冷凝管,缓慢加热回流2 h至反应完全。
第二步:将反应容器中液体倒入盛有适量5%Na2CO3溶液的烧杯中,搅拌并分出有机相后,再用水洗。
第三步:将无水CaCl2加入到水洗后的产品中充分静置,过滤、蒸馏,得产品7.08 g。
(1)第一步操作中,还缺少的试剂是______________________;加入苯的目的是_________________;实验过程中,若油水分离器中水层不再增厚,则表明___________________________________。
(2)第二步中证明“水洗”已经完成的实验方案是_______________________________ 。
(3)本实验制备乳酸乙酯的产率为_________________________。
Ⅱ.磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强,易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05m·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:
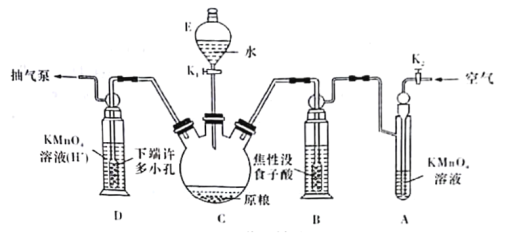
(操作流程)安装吸收装置![]() PH3的产生与吸收
PH3的产生与吸收![]() 转移KMnO4吸收溶液
转移KMnO4吸收溶液![]() 亚硫酸钠标准溶液滴定。
亚硫酸钠标准溶液滴定。
(实验装置)C中盛100 g原粮,D中盛有20.00mL 1.12×10-4 mol·L-1KMnO4溶液(H2SO4酸化)。请回答下列问题:
(4)仪器C的名称是______________;检查整套装置气密性的方法是___________________________________________________________________________。
(5)A中盛装KMnO4,溶液的作用是除去空气中的还原性气体;B中盛装焦性没食子酸的碱性溶液.其作用是______________________________。D中PH3被氧化成磷酸,所发生反应的离子方程式为____________________________________________。
(6)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5 mol·L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗标准Na2SO3溶液11.00 mL,则该原粮中磷化物(以PH3计)的含量为_________________________mg·kg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发、使用清洁能源发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)![]() CH3OH(g) △H= -90.8kJmol-1。
CH3OH(g) △H= -90.8kJmol-1。
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为____,以CH3OH表示该过程的反应速率v(CH3OH)=______。
②要提高反应2H2(g)+CO(g)CH3OH(g)中CO的转化率,可以采取的措施是_______。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2 e.加入惰性气体 f.分离出甲醇
(2)①氢氧燃料电池是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)燃料电池。如果是酸性燃料电池,则正极反应方程式是____________。
②科研人员设想用如图原电池装置生产硫酸,则负极的电极反应式为__________。
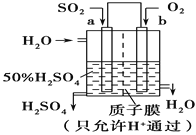
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构![]() ,有机物A的键线式结构为
,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A. 用系统命名法命名有机物A,名称为2,2,3﹣三甲基戊烷
B. 有机物A的一氯取代物只有4种
C. 有机物A的分子式为C8H18
D. B的结构可能有3种,其中一种名称为3,4,4﹣三甲基﹣2﹣戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,常用于纺织工业、食品漂白等领域。某种Na2S2O4的生产工艺流程如图所示:若在实验室模拟该工艺流程,下列说法错误的是
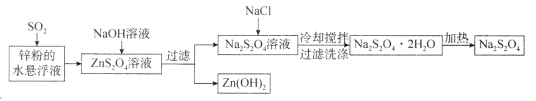
A.将锌粉投入水中形成悬浮液主要是为了加快反应速率
B.向Na2S2O4溶液中加NaCl溶液或固体对Na2S2O4的产率无明显影响
C.洗涤Na2S2O4·2H2O时用冰水效果好于常温蒸馏水
D.该流程中涉及化合反应、分解反应、复分解反应,不涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质X在一定条件下可转化为物质Y或物质Z:
![]()
![]()
两个反应的能量变化如图所示,下列说法正确的是
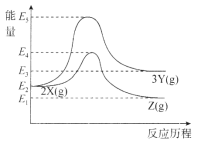
A.两个反应均为放热反应
B.X、Y、Z的关系是互为同素异形体或同分异构体
C.X转化为Y的活化能高于X转化为Z的活化能
D.其它条件一定,加压有利于提高X转化为Z的速率和平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是用途最广泛的基本有机原料,可用于生产塑料、合成橡胶等产品。工业上可用乙烷、二氧化碳、甲醇、乙醇等为原料制乙烯。请回答下列相关问题。
(1)已知H2、C2H4、C2H6的燃烧热依次是286kJ/mol、1411kJ/mol、1560kJ/mol,乙烷热裂解制乙烯的热化学方程式是![]() ,则
,则![]() =_______________。
=_______________。
(2)工业上用乙烷热裂解制乙烯时,通常会在保持起始压强不变的情况下用水蒸气对乙烷稀释以提高平衡转化率,其原理是______________________________________________。
向温度为1015K、体积为5L的刚性容器中充入0.03mol水蒸气和0.06mol乙烷,起始压强为0.15MPa,30s后体系达到平衡,乙烷的平衡转化率为60%,则建立平衡的过程中平均反应速率v(H2)=______________mol/(L·s),![]() 的平衡常数KP=_______________MPa。
的平衡常数KP=_______________MPa。
(3)二氧化碳的资源化是目前的热门研究领域,在催化剂的作用下二氧化碳可以和氢气发生反应生成甲烷和低级烯烃CnH2n(n=2~4)。其它条件一定时,反应温度对CO2转化率、CH4选择性、CnH2n选择性的影响如下图所示,从生产低级烯烃的角度考虑,最合适的反应温度是___________。资料显示原料气中![]() 时,随着
时,随着![]() 的增大,低级烯烃的选择性会逐渐降低,但氢气的总转化率不发生明显变化,原因可能是_____________________________________________________________________。
的增大,低级烯烃的选择性会逐渐降低,但氢气的总转化率不发生明显变化,原因可能是_____________________________________________________________________。
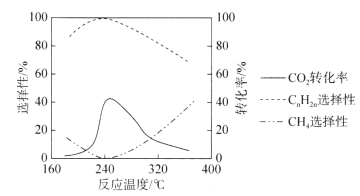
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 可用于工业上制备 Na2S2O3。下列化学用语表示正确的是
A.中子数为20的硫原子:![]() S
S
B.Na+的结构示意图:
C.Na2S的电子式:![]()
D.CO32-水解的离子方程式 CO32-+2H2O=H2CO3+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com