
����Ŀ��������������(Na2S2O4)�׳Ʊ��շۣ������ڷ�֯��ҵ��ʳƷƯ������ij��Na2S2O4����������������ͼ��ʾ������ʵ����ģ��ù������̣�����˵���������
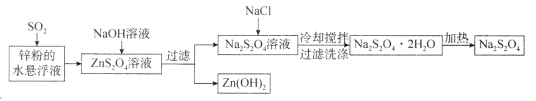
A.��п��Ͷ��ˮ���γ�����Һ��Ҫ��Ϊ�˼ӿ췴Ӧ����
B.��Na2S2O4��Һ�м�NaCl��Һ������Na2S2O4�IJ���������Ӱ��
C.ϴ��Na2S2O4��2H2Oʱ�ñ�ˮЧ�����ڳ�������ˮ
D.���������漰���Ϸ�Ӧ���ֽⷴӦ�����ֽⷴӦ�����漰������ԭ��Ӧ
���𰸡�BD
��������
������ͼ��֪��п�����������Ӧ����ZnS2O4����ZnS2O4��Һ�м�������������Һ�����߷�Ӧ����������п������Na2S2O4�����˺���Na2S2O4��Һ�м���NaCl���彵��Na2S2O4�ܽ�ȣ�����Na2S2O4��2H2O���壬���˺���Na2S2O4��2H2O������ȥ�ᾧˮ����Na2S2O4��
A.��п��Ͷ��ˮ���γ�����Һ���������������ĽӴ�������ӿ췴Ӧ���ʣ���A��ȷ��
B.��![]() �������ȴ���趼�������ܽ�ƽ�������ƶ��������������
�������ȴ���趼�������ܽ�ƽ�������ƶ��������������![]() ����ʹ��
����ʹ��![]() ��Һ���ή��������Ũ��ʹ������
��Һ���ή��������Ũ��ʹ������![]() ���٣�
���٣�![]() ���ʽ��ͣ���B����
���ʽ��ͣ���B����
C.�ñ�ˮϴ�ӿɼ���![]() ����ʧ����C��ȷ��
����ʧ����C��ȷ��
D.п�����������ķ�Ӧ�ǻ��Ϸ�Ӧ����Ӧ��Ԫ���л��ϼ۱仯��Ҳ��������ԭ��Ӧ��![]() ��Һ��
��Һ��![]() ��Һ�ķ�Ӧ�Ǹ��ֽⷴӦ������
��Һ�ķ�Ӧ�Ǹ��ֽⷴӦ������![]() �ķ�Ӧ�ǷֽⷴӦ����D����
�ķ�Ӧ�ǷֽⷴӦ����D����
��ѡBD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ�Ķ��ֻ����������������ж��й㷺��;����ش��������⣺
��1��Cu2O��CuO��ͭ������������ɻ���ת������֪��
i.2Cu2O(s)��O2(g)=4CuO(s) ��H=-292.0kJ��mol-1
ii.C(s)��2CuO(s)=Cu2O(s)��CO(g) ��H=��35.5kJ��mol-1
��CO��ȼ����Ϊ283.0kJ��mol-1����C(s)��ȼ����Ϊ___��
��2��Cu2O��CuO������������
�����ӽ���Ĥȼ�ϵ��(PEMFC)��ȼ�����г�����H2�����������CO��CO2������CO��PEMFC���������ض�����������CuO/CeO2���������������ѳ�CO��160�桢��CuO/CeO2������ʱ������CO�Ļ�ѧ����ʽΪ___���ֱ���HIO3��H3PO4��CuO/CeO2���д�������һ�������£����ò�ͬ��������CO�����ĶԱ�ʵ�飬����ͼ���ߣ����д���___ (����b������c��)��������ã�120��ʹ�ô���b������������ȼ������CO���������Ϊ0.71%����������Ϊ2000mL��h-1����1h��CO���Ϊ___mL��

����Cu2O�������ºϳ�CH3OH����Ӧ���£�CO(g)��2H2(g)![]() CH3OH(g) ��H=-90.0kJ��mol-1����������߸÷�ӦCO��ƽ��ת���ʵ�������___(����)��
CH3OH(g) ��H=-90.0kJ��mol-1����������߸÷�ӦCO��ƽ��ת���ʵ�������___(����)��
A.���µ�ѹ B.���¸�ѹ C.���¸�ѹ D.���µ�ѹ
T��ʱ����CO��H2��һ��������Ϻ�Ͷ���ݻ�Ϊ2L�ĺ����ܱ������У�CO����ʼŨ��Ϊ1.0mol��L-1��ƽ��ʱ�������ϵ�У�n(H2)=1.4mol��n(CH3OH)=1.7mol����Ӧ�ﵽƽ��ʱCO��ת����Ϊ___������Ӧ�ﵽƽ��״̬���������������䣬�ٳ���0.2molCO��0.2molCH3OH��ƽ����___(����������������)��Ӧ�����ƶ���������___��
��3��CuS�ʺ�ɫ���������ܵ�����֮һ����������������ʹ��һЩ���Ʋ����ܵķ�Ӧ���Է�������0.01mol��L-1CuSO4��Һ�У�����ͨ��H2Sά�ֱ���(H2S����Ũ��Ϊ0.1mol��L-1)��������Ӧ��H2S(aq)��Cu2��(aq)![]() CuS(s)��2H��(aq)���÷�Ӧ�Ļ�ѧƽ�ⳣ��KΪ___(����2λ��Ч����)����֪��Ka1(H2S)=1.1��10-7��Ka2(H2S)=1.3��10-13��Ksp(CuS)=6.3��10-36��
CuS(s)��2H��(aq)���÷�Ӧ�Ļ�ѧƽ�ⳣ��KΪ___(����2λ��Ч����)����֪��Ka1(H2S)=1.1��10-7��Ka2(H2S)=1.3��10-13��Ksp(CuS)=6.3��10-36��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ɱ���ܱ������У�����һ������X��Y��������Ӧ��mX(g)![]() nY(g)����H��Q kJ/mol����Ӧ�ﵽƽ��ʱ��Y�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ���±���ʾ��
nY(g)����H��Q kJ/mol����Ӧ�ﵽƽ��ʱ��Y�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ���±���ʾ��
1L | 2L | 4L | |
100�� | 1.00mol/L | 0.75mol/L | 0.53mol/L |
200�� | 1.20mol/L | 0.90mol/L | 0.63mol/L |
300�� | 1.30mol/L | 1.00mol/L | 0.70mol/L |
����˵����ȷ����(����)
A.�¶Ȳ��䣬ѹǿ����Y��������������
B.������䣬�¶����ߣ�ƽ�����淴Ӧ�����ƶ�
C.m��n
D.Q��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�����ӽṹʽ����ͼ������˵����ȷ����( )

A. ȡ�������л������μ����Ը��������Һ���������������
B. ���е�̼ԭ�Ӳ����ܴ���ͬһ��ƽ����
C. ���е���ԭ�Ӳ�����ͬʱ���ڱ���ƽ����
D. ���е���ԭ���п���ͬʱ���ڱ���ƽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��Ԫ�����ڱ��е�λ����ͼ��ʾ������˵����ȷ����( )
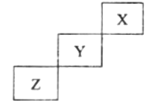
A.�ǽ�����ǿ��: Z> Y
B.��̬�⻯����ȶ���: Y>Z
C.����������ˮ��������: Y>Z
D.��ѹ��X�ĵ��ʻ�ѧ���ʷdz�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�������������
I.�������������
��14C ��16O ��14N ��18O ��O2 ��O3
��CH3-CH3 ��C2H6 ��CH3- CH2-OH �� CH3-O-CH3
(1)��Ϊͬλ�ص���______��(����ţ���ͬ)��������ͬ��������ͬ����______________
(2)��Ϊͬ�����������_________, ��Ϊͬ���칹�����_____________________
II.��25 C��101 kPa�������£�

���ڷ�ӦH2(g)+Cl2(g)= 2HCl(g), �������2 mol HCI(g)ʱ,��Ӧ�����зų�183 kJ����������Ͽ�1 mol H- Cl�������������____ kJ.

III.��ͼ��ʾ��ԭ���װ���У������ĵ缫��Ӧ����ʽ��________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������10mL0.1mol��L��NaCN��Һ�еμӵ�Ũ�ȵ�����(����������¶ȱ仯)����(HCN)��![]() ����ҺpH�仯��ͼ����ͼ��ʾ������˵���������
����ҺpH�仯��ͼ����ͼ��ʾ������˵���������
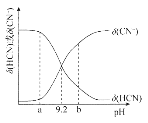
A.������HCN�ĵ��볣��Ϊl0��9.2
B.pHΪ9.2ʱ������������������5mL
C.pHΪaʱ��Һ��c(Cl��)����pHΪbʱ��Һ��c(Cl��)
D.�μӹ����п��ܳ��֣�c(Na+)��c(CN��)��c(OH��)��c(Cl��)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����Ƴ���һ��Ư��Ч�ʼ��ߵ�����Ư��(�ṹ��ͼ��ʾ),����W��X��Y��Z��Ϊ������Ԫ����ԭ�����������������£�0.1 mol/L Z���⻯���ˮ��Һ��c(H+ )=0.1 mol/L����Z��Yλ�ڲ�ͬ���ڡ�����������ȷ����
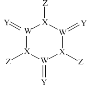
A.ԭ�Ӱ뾶:W> X> YB.�⻯��ķе�:Y >X> Z> W
C.X���������ˮ������ǿ��D.Y�ĵ��ʾ�����ɱ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѪҺ��pHͨ����7.35-7.45֮���ԭ����ѪҺ�д���NaH2PO4-Na2HPO4�Ȼ�����ϵ�������£�Ka1(H3PO4)=7.6��10-3��Ka2(H3PO4)=6.3��10-8������ָ����Һ�������ʵ���Ũ�ȹ�ϵ��ȷ����
A.0.1mol/L NaH2PO4��Һ��2c(HPO42-)+3c(PO43-)��c(Na+)-c(H2PO4-)
B.�����£�pH=7��NaH2PO4��Na2HPO4�Ļ����Һ��c(Na+)��c(HPO42-)��c(H2PO4-)
C.��10 mL0.1mol/L NaH2PO4��Һ�м���5mL 0.4 mol/L NaOH��Һ��c(H+)+3c(H3PO4)+2c(H2PO4-)+c(HPO42-)=c(OH-)
D.���ʵ���Ũ�����NaH2PO4��Na2HPO4��Һ�������ϣ�3[c(H2PO4-)+c(HPO42-)+c(PO43-)]=2c(Na+)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com