
【题目】常温下向10mL0.1mol/L的NaCN溶液中滴加等浓度的盐酸(忽略体积和温度变化),δ(HCN)和![]() 随溶液pH变化的图像如图所示,下列说法错误的是
随溶液pH变化的图像如图所示,下列说法错误的是
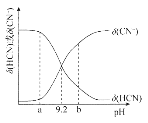
A.常温下HCN的电离常数为l0-9.2
B.pH为9.2时,加入盐酸的体积大于5mL
C.pH为a时溶液中c(Cl-)大于pH为b时溶液中c(Cl-)
D.滴加过程中可能出现:c(Na+)>c(CN-)>c(OH-)>c(Cl-)>c(H+)
科目:高中化学 来源: 题型:
【题目】如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )

A. 两条曲线间任意点均有c(H+)·c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发、使用清洁能源发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)![]() CH3OH(g) △H= -90.8kJmol-1。
CH3OH(g) △H= -90.8kJmol-1。
①某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为____,以CH3OH表示该过程的反应速率v(CH3OH)=______。
②要提高反应2H2(g)+CO(g)CH3OH(g)中CO的转化率,可以采取的措施是_______。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2 e.加入惰性气体 f.分离出甲醇
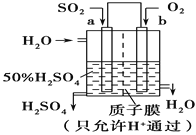
(2)①氢氧燃料电池是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)燃料电池。如果是酸性燃料电池,则正极反应方程式是____________。
②科研人员设想用如图原电池装置生产硫酸,则负极的电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,常用于纺织工业、食品漂白等领域。某种Na2S2O4的生产工艺流程如图所示:若在实验室模拟该工艺流程,下列说法错误的是
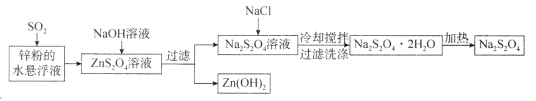
A.将锌粉投入水中形成悬浮液主要是为了加快反应速率
B.向Na2S2O4溶液中加NaCl溶液或固体对Na2S2O4的产率无明显影响
C.洗涤Na2S2O4·2H2O时用冰水效果好于常温蒸馏水
D.该流程中涉及化合反应、分解反应、复分解反应,不涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质X在一定条件下可转化为物质Y或物质Z:
![]()
![]()
两个反应的能量变化如图所示,下列说法正确的是
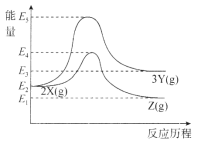
A.两个反应均为放热反应
B.X、Y、Z的关系是互为同素异形体或同分异构体
C.X转化为Y的活化能高于X转化为Z的活化能
D.其它条件一定,加压有利于提高X转化为Z的速率和平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置进行的相应实验,不能达到实验目的的是

A.用图1所示装置制取氨气
B.用图2所示装置证明非金属性强弱:S>C> Si
C.用图3所示装置证明酸性强弱:硝酸>碳酸>硅酸
D.用图4所示装置制备少量的乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是用途最广泛的基本有机原料,可用于生产塑料、合成橡胶等产品。工业上可用乙烷、二氧化碳、甲醇、乙醇等为原料制乙烯。请回答下列相关问题。
(1)已知H2、C2H4、C2H6的燃烧热依次是286kJ/mol、1411kJ/mol、1560kJ/mol,乙烷热裂解制乙烯的热化学方程式是![]() ,则
,则![]() =_______________。
=_______________。
(2)工业上用乙烷热裂解制乙烯时,通常会在保持起始压强不变的情况下用水蒸气对乙烷稀释以提高平衡转化率,其原理是______________________________________________。
向温度为1015K、体积为5L的刚性容器中充入0.03mol水蒸气和0.06mol乙烷,起始压强为0.15MPa,30s后体系达到平衡,乙烷的平衡转化率为60%,则建立平衡的过程中平均反应速率v(H2)=______________mol/(L·s),![]() 的平衡常数KP=_______________MPa。
的平衡常数KP=_______________MPa。
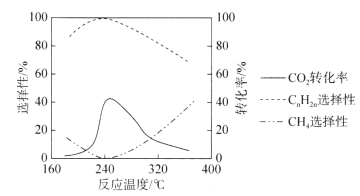
(3)二氧化碳的资源化是目前的热门研究领域,在催化剂的作用下二氧化碳可以和氢气发生反应生成甲烷和低级烯烃CnH2n(n=2~4)。其它条件一定时,反应温度对CO2转化率、CH4选择性、CnH2n选择性的影响如下图所示,从生产低级烯烃的角度考虑,最合适的反应温度是___________。资料显示原料气中![]() 时,随着
时,随着![]() 的增大,低级烯烃的选择性会逐渐降低,但氢气的总转化率不发生明显变化,原因可能是_____________________________________________________________________。
的增大,低级烯烃的选择性会逐渐降低,但氢气的总转化率不发生明显变化,原因可能是_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生活中或实验中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验原理:电极(______、______)、________、________、稀硫酸、耳机(或者电流计)。(请在空格中填写所缺的实验用品)
(3)实验装置(如图)。
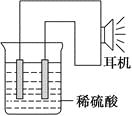
(4)原电池设计及注意的问题:
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓……”的声音。其原因是:在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的________极,电极反应是_____________________________,发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池己被广泛用作便携式电源。正极材料为LiCoO2、LiFePO4等,负极材料一般为石墨碳,以溶有LiPF6、LiBF4等的碳酸二乙酯(DEC)作电解液。
(1)Fe2+基态核外电子排布式为 ________。
(2)PO43-的空间构型为 ________ (用文字描述)。
(3)![]() 中
中![]() 的配位数为6,该配合物中的配位原子为 _____。
的配位数为6,该配合物中的配位原子为 _____。
(4)碳酸二乙酯(DEC)的分子结构如图所示,分子中碳原子的轨道杂化类型为_____,1mol碳酸二乙酯(DEC)中含有σ键的数目为_____。
![]()
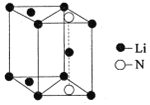
(5)氮化锂是一种新型无机贮氢材料,其晶胞结构如图所示,该晶体的化学式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com