
【题目】下列溶液中,物质的量浓度最大的是
A.将30ml 5mol/L NaOH溶液加水稀释到100ml,稀释后溶液中的NaOH的物质的量浓度
B.0.5 L 含 49 g H2SO4 的溶液
C.将 1mol Na2O 溶于水并配成 1 L 的溶液
D.含 K+为 1mol/L的 K2SO4 溶液
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某混合物A含有![]() 、
、![]() 和
和![]() ,在一定条件下可实现如图所示的物质之间的变化:
,在一定条件下可实现如图所示的物质之间的变化:
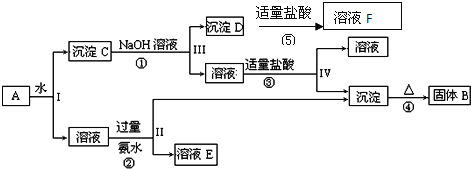
据此回答下列问题:
![]() 、II、III、IV四步中对于溶液和沉淀的分离采取的方法是______.
、II、III、IV四步中对于溶液和沉淀的分离采取的方法是______.
![]() 根据上述框图反应关系,写出下列B、D所含物质的化学式固体B______;沉淀D______;
根据上述框图反应关系,写出下列B、D所含物质的化学式固体B______;沉淀D______;
![]() 写出
写出![]() 的化学方程式 _____________;
的化学方程式 _____________;
![]() 写出
写出![]() 、
、![]() 两个反应的离子方程式
两个反应的离子方程式![]() ___________________;
___________________;![]() _______________;
_______________;
(5)写出![]() 在工业上的一种主要用途:_________________。
在工业上的一种主要用途:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若mg Na在足量氯气中燃烧,生成固体的质量为(m+3.55)g,则mg Na与氧气反应,生成固体的质量为( )
①(m+0.8)g ②(m+1.0)g ③(m+1.2)g ④(m+1.6)g ⑤(m+1.4)g
A.仅①④B.仅①⑤C.仅③④D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。
(装置分析)
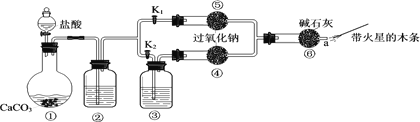
(1)装置①中反应的离子方程式是______。
(2)装置②中的试剂是______(填序号)。
a.饱和Na2CO3溶液 b.饱和NaHCO3溶液 c.浓H2SO4
(3)装置③中的试剂是______。
(进行实验)步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。 步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
(4)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是______。
(5)过氧化钠跟二氧化碳反应的化学方程式是______。
(实验反思)
(6)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应。”其理由是______。
(7)需要补充的实验操作是:取⑤中反应后的少量固体,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种化合物均由短周期元素组成。其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有如下图转化关系(部分反应物、产物及反应条件已略去)。请回答:
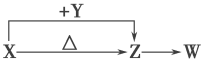
(1)Y的电子式是____________________。
(2)X与Y在溶液中反应的离子方程式是__________________________________________。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。
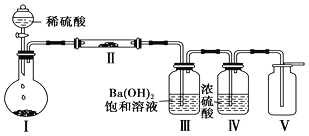
①装置Ⅰ中反应的化学方程式是_________________________________________________,装置Ⅱ中反应的化学方程式是________________________________________________。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是___________,所需仪器装置是_______________。 (从上图选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25 gmL﹣1、质量分数为36.5%的浓盐酸配制240 mL 0.1 molL﹣1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为________________________。
(2)配制240 mL 0.1 molL﹣1的盐酸
应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
__________ | __________ |
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)__________。
A.用30 mL水洗涤烧杯内壁和玻璃棒23次,洗涤液均注入容量瓶,振荡
B.用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线12 cm处
(4)若实验中遇到下列情况,对配制盐酸的物质的量浓度有何影响(填“偏高”“偏低”或“不变”)
①用于稀释盐酸的烧杯未洗涤__________________________________________;
②容量瓶中原有少量蒸馏水____________________________________________;
③定容时俯视观察液面________________________________________________。
(5)若实验过程中出现如下情况如何处理?
①定容时加蒸馏水时超过了刻度________________________________________;
②向容量瓶中转移溶液时不慎有溶液溅出________________________________;
③定容摇匀后发现液面下降____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产生活及科学研究方面应用非常广泛。回答下列问题:
(1)Fe原子的核外电子排布式为_________。
(2)含锰奥氏体钢是一种特殊的铁合金,主要由Fe和Mn组成,其中锰能增加钢铁的强度和硬度,提高耐冲击性能和耐磨性能。第三电离能I3(Fe)____I3(Mn)(填“大于”或“小于”),原因___。
(3)工业电解熔融的FeO、Fe2O3冶炼高纯铁。FeO与Fe2O3相比,_____熔点高,其主要原因是_______。
(4)FeCl3可与KSCN溶液发生显色反应。SCN-的三种元素中电负性最大的是_______。
(5)液态环戊二烯中存在的微粒间相互作用有____
A 范德华力 B 氢键 C ![]() 键 D π键
键 D π键
环戊二烯分子中碳原子的杂化轨道类型是_____
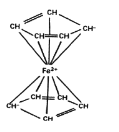
配合物中配体提供电子对的方式包括孤对电子、π电子等。二茂铁的分子结构如图所示,其中铁的配位数是____。
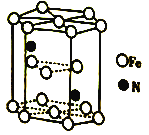
(6)Fe(CO)3与NH3在一定条件下可合成一种具有磁性的氮化铁。该磁性氮化铁的晶胞结构如图所示。六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,该磁性氮化铁的密度为____(列出计算式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应: A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是
2C(g)+D(g)已达平衡状态的是
A. 混合气体的压强B. 混合气体的密度
C. 3v逆(C)=2v正(B)D. 气体的平均相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com