
【题目】甲、乙、丙分别是由Na、O、H形成的单质,A、B、C是由H、0、Na三种元素中的两种或三种组成的化合物,各种单质与化合物之问存在如图所示的转化笑系:

请回答:
(1)写出下列物质的化学式A________,B_________,C_______。
(2)写出下列反应的化学方程式:
①单质甲+化合物B_____________________________。
②化合物A+化合物B___________________________。
【答案】Na202H20NaOH2Na+2H20=2NaOH+ H2↑2Na202+2H20=4NaOH+02↑
【解析】
甲、乙、丙分别是由Na、O、H形成的单质,A、B、C是由H、0、Na三种元素中的两种或三种组成的化合物,其中化合物A与化合物B反应生成单质乙和化合物C,该反应是过氧化钠和水反应生成氧气和氢氧化钠,则乙是氧气,C是氢氧化钠。甲与B反应生成氢氧化钠和丙,则甲是钠,B是水,丙是氢气,所以A是过氧化钠,据此解答。
根据以上分析知甲是Na,乙是O2,丙是H2,A是Na2O2,B是H2O,C是NaOH,则
(1)通过以上分析知,化合物A、B、C的化学式分别是Na2O2、H2O、NaOH;
(2)单质甲与化合物B反应生成氢氧化钠和氢气,反应的化学方程式为2Na+2H20=2NaOH+H2↑;化合物A与化合物B反应生成氧气和氢氧化钠的反应方程式为2Na202+2H20=4NaOH+02↑。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 需要加热才能发生的反应一定是吸热反应
B. 浓硫酸溶于水是放热反应
C. 反应物和生成物所具有的总能量决定了放热还是吸热
D. 断开化学键放热,形成化学键吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子浓度变化如右图所示。下列有关说法正确的是

A. 常温下,PbI2的Ksp为2×10-6
B. 常温下,Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的化学平衡常数为5×1018
PbS(s)+2I-(aq)的化学平衡常数为5×1018
C. 温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大
D. 温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,平衡向左移动,Pb2+的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳碳双键有如下所示的断裂方式:
 ;
;
 。
。
高分子单体A(C6H10O3)可进行如下反应(反应框图)

已知:
Ⅰ.对框图中某些化合物性质的说明:A在室温下不与NaHCO3溶液反应,但可与Na反应放出H2;B可与NaHCO3溶液反应放出CO2;C可与Na反应放出H2而D不能;G在室温下既不与NaHCO3溶液反应,也不与Na反应放出H2。
Ⅱ.两个一OH连在同一个C原子上的结构不稳定。
(1)写出反应①中(1)的反应类型:___________;写出D的键线式:____________________。
(2)写出物质E所含官能团的名称: ____________________。
(3)B在浓H2SO4存在下与甲醇共热反应生成的有机物的系统名称为____________________。
(4)写出F→G的化学反应方程式:____________________________________。
(5)与B互为同分异构体,分子为链状的酯类物质共有______________种(不考虑立体异构)。
(6)请设计合理方案,用物质E制备乙二酸(其他原料自选,用反应流程图表示,并注明必要的反应条件) ______________。例如:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是( )
A. Na2CO3+CaCl2=CaCO3↓+2NaCl
B. Fe+CuSO4=Cu+FeSO4
C. 2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
D. CaO+H2O=Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.5 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH 溶液在右图所示的装置(代替量热计)中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
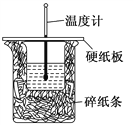
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________。
(2)烧杯间填满碎纸条的作用是___________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大”“偏小”“无影响”)。
(4)实验中改用 60 mL 0.50 mol· L-1的盐酸跟 50 mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”)。
(5)实验中改用 50mL 0.50 mol· L-1的醋酸跟 50 mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”)。简述理由______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液时,由于操作不慎,使液面略超过了容量瓶的刻度(标线),这时应采取的措施是( )
A.倾出标线以上的液体
B.吸出标线以上的溶液
C.影响不大,不再处理
D.重新配制
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物G分子结构的球棍模型如下图所示(图中小球分别表示碳、氢、氧原子,球与球之间的连线“一”不一定是单键)。用芳香烃A为原料合成G的路线如下:
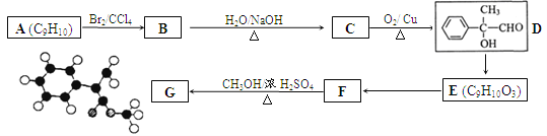
试回答:
(1)G的分子式为 ____________。
(2)A的结构简式为 ___________;D中官能团的名称为 __________。
(3)B→C反应的化学方程式是 ____________________________。
(4)E的同分异构体中可用通式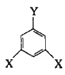 表示(其中X、Y均不为H),且能发生银镜反应的物质有______种,其中核磁共振氢谱有6个峰的物质结构简式为 (写出一种即可)_________________。
表示(其中X、Y均不为H),且能发生银镜反应的物质有______种,其中核磁共振氢谱有6个峰的物质结构简式为 (写出一种即可)_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在工业上的应用十分广泛。请回答下列问题:
(1)工业上将氯气通入石灰乳制取漂白粉,漂白粉的有效成分是(填化学式)_______。
(2)超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:Al2O3+N2+3C![]() 2AlN+3CO。由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中A1N的质量分数,进行了以下实验:称取10g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。
2AlN+3CO。由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中A1N的质量分数,进行了以下实验:称取10g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。
①AlN跟NaOH溶液反应的化学方程式为________________________;
②该样品中的A1N的质量分数为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com