
【题目】完成下列问题:
(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.
①滴定管如图所示,用(填“甲”或“乙”)滴定管盛待测定的未知浓度的盐酸溶液.
②用滴定的方法来测定盐酸的浓度,实验数据如表所示:
实验编号 | 待测盐酸溶液的体积/mL | 滴入NaOH溶液的体积/mL |
1 | 20.00 | 23.00 |
2 | 20.00 | 23.10 |
3 | 20.00 | 22.90 |
该未知盐酸的浓度为(保留两位有效数字).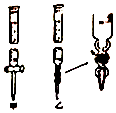
(2)若用酚酞作指示剂,达到滴定终点的标志是 .
(3)造成测定结果偏高的操作可能是 .
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的读数时,滴定前仰视凹液面最低处,滴定后俯视读数.
【答案】
(1)甲;0.92mol/L
(2)无色变粉红色且30s不变色
(3)BC
【解析】解:(1)①由图可知,甲有活塞,为酸式滴定管,用甲滴定管盛待测定的未知浓度的盐酸溶液,所以答案是:甲; ②消耗NaOH为 ![]() =23.00mL,c(酸)=
=23.00mL,c(酸)= ![]() =0.92 mol/L,所以答案是:0.92 mol/L;(2)若用酚酞作指示剂,开始为无色,滴定终点时变为粉红色达到滴定终点的标志是无色变粉红色且30 s不变色,所以答案是:无色变粉红色且30 s不变色; (3)A.盛装待测液的锥形瓶用水洗后未干燥,对实验无影响,故A不选;
=0.92 mol/L,所以答案是:0.92 mol/L;(2)若用酚酞作指示剂,开始为无色,滴定终点时变为粉红色达到滴定终点的标志是无色变粉红色且30 s不变色,所以答案是:无色变粉红色且30 s不变色; (3)A.盛装待测液的锥形瓶用水洗后未干燥,对实验无影响,故A不选;
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失,V(NaOH)偏大,则测定结果偏高,故B选;
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗,消耗V(NaOH)偏大,则测定结果偏高,故C选;
D.读碱式滴定管的读数时,滴定前仰视凹液面最低处,滴定后俯视读数,V(NaOH)偏小,则测定结果偏低,故D不选;
所以答案是:BC.
【考点精析】利用酸碱中和滴定对题目进行判断即可得到答案,需要熟知中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点.


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了如下图所示的实验装置。己知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O

回答下列问题:
(1)甲装置中仪器a的名称是_________________,MnO2在反应中所起的作用是_____________。
(2)装置乙中饱和食盐水的作用是_________________。
(3)①制取漂白粉的化学方程式是____________________。
②该小组制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],其主要原因是____________________。
③为提高Ca(ClO)2的含量,可采取的措施是___________________(任写一种即可)。
(4)漂白粉应密封保存,原因是__________、_________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组的同学设计了如下实验装置制备SnCl4。
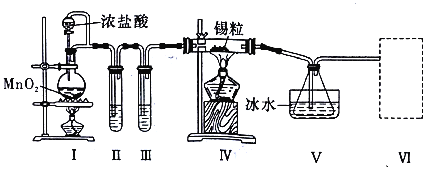
已知:①金属锡熔点为231℃,化学活泼性与铁相似;
②纯净而干燥的氯气与熔融金属锡反应生成SnCl4,SnCl4的沸点为114℃;
③SnCl4易与水反应。
请根据上图装置回答:
(1)裝置I中发生反应的离子方程式是______________。
(2)试管II中的试剂是________,试管III中的试剂是____________。
(3)装置V的作用是____________。
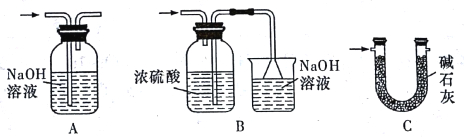
(4)裝置Ⅵ 最好选用下列装置中的____(填标号)。
(5)实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的玻璃仪器有_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下甲醇与一氧化碳反应可以合成乙酸.通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO﹣),用含a和b.的代数式表示该混合溶液中醋酸的电离常数为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件)。

(1)若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则X单质在常温下的颜色为 。
(2)若X是常温下密度最小的气体,Y由两种非金属元素组成,其中一种在地壳中的含量仅次于氧,另一种在海水中的含量仅次于氢和氧,则Z的化学式为 。
(3)若X原子的质子数是W原子质子数的2倍,且X原子最外层电子数为2。则W的原子结构示意图为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置制取ClO2 , 并以ClO2为原料制备亚氯酸钠(NaClO2是一种高效氧化剂、漂白剂).已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl. 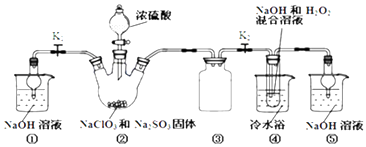
完成下列填空:
(1)装置②中产生ClO2的化学方程式为;装置④中发生反应的离子方程式为 .
(2)装置③的作用是;装置①和⑤在本实验中的作用 .
(3)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤;③用50℃左右的温水洗涤;④低于60℃干燥,得到成品.步骤③中用50℃左右的温水洗涤的原因是 .
(4)亚氯酸钠纯度测定:①准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应.将所得混合液配成250mL待测溶液.②取25.00mL待测液,用2.0 molL﹣1Na2S2O3标准液滴定(I2+2S2O32﹣=2I﹣+S4O62﹣),以淀粉溶液做指示剂,达到滴定终点时的现象为 . 重复滴定3次,测得数据如表所示,则该样品中NaClO2的质量分数为 .
实验序号 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.00 | 19.96 |
2 | 3.26 | 23.30 |
3 | 1.10 | 23.40 |
(5)实验过程中若NaClO2变质可分解为NaClO3和NaCl.取等质量NaClO2 , 其中一份加热高于60℃使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量(填“相同”“不相同”或“无法判断”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一定质量的镁、铝混合物投入到1mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入1mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如下图所示。则:
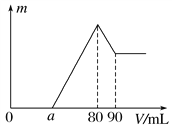
(1)金属铝的质量为________。
(2)a的取值范围是________________。
(3)![]() 的最大值是________。
的最大值是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com