
【题目】把一定质量的镁、铝混合物投入到1mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入1mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如下图所示。则:
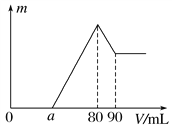
(1)金属铝的质量为________。
(2)a的取值范围是________________。
(3)![]() 的最大值是________。
的最大值是________。
【答案】 0.27g 0≤a<50 2.5
【解析】(1)根据图可知,首先发生的反应是中和过量的酸:H++OH-=H2O,然后是沉淀两种金属离子:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,最后是Al(OH)3的溶解:Al(OH)3+OH-=[Al(OH)4]-,从横坐标80mL到90mL这段消耗氢氧化钠是10mL,物质的量是0.01mol,则可以求出n[Al(OH)3]=0.01mol,则n(Al)=n[Al(OH)3]=0.01mol,即为0.27g;(2)假设盐酸溶解金属后不剩,这种情况下,酸恰好与合金反应完全,即a=0,通过极值法,当合金中完全是铝时,因为沉淀Al3+需要NaOH溶液的体积为30mL,从图可知,中和过量的酸所消耗的碱液体积最大为50mL,但是假设不成立,最大值是不存在的,所以的取值范围为0≤a<50;(3)n(Al)=n[Al(OH)3]=0.01mol,所以沉淀Al3+需要的OH-为0.03mol,即NaOH溶液的体积为30mL,镁离子和铝离子沉淀完全消耗的碱的体积为80-a,若假设盐酸不剩,所以沉淀Mg2+需要NaOH溶液的体积最大值为50mL,物质的量是0.05mol,因此求出n(Mg)的最大值为0.025mol,所以该合金中镁铝两元素物质的量之比的最大值为2.5。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】完成下列问题:
(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.
①滴定管如图所示,用(填“甲”或“乙”)滴定管盛待测定的未知浓度的盐酸溶液.
②用滴定的方法来测定盐酸的浓度,实验数据如表所示:
实验编号 | 待测盐酸溶液的体积/mL | 滴入NaOH溶液的体积/mL |
1 | 20.00 | 23.00 |
2 | 20.00 | 23.10 |
3 | 20.00 | 22.90 |
该未知盐酸的浓度为(保留两位有效数字).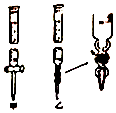
(2)若用酚酞作指示剂,达到滴定终点的标志是 .
(3)造成测定结果偏高的操作可能是 .
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的读数时,滴定前仰视凹液面最低处,滴定后俯视读数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2SO4、NaCl、NaOH的混合溶液中,含有Na+、SO42-、OH-的个数比是8∶1∶2,则溶液中Na2SO4、NaCl、NaOH的物质的量之比是
A. 1∶1∶1B. 1∶2∶4C. 1∶3∶2D. 1∶4∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度不变恒容的容器中0.1molL﹣1H2进行反应H22H,若某段时间内H2浓度由0.06molL﹣1降到0.036molL﹣1所需的反应时间为12s,则反应起始时H2浓度由0.1molL﹣1降到0.06molL﹣1需的时间为( )
A.等于24s
B.等于20s
C.大于20s
D.小于20s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组只领取下列仪器和用品:铁架台、铁夹、铁圈、三角架、石棉网、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴、滤纸。不能进行的实验操作是
A. 蒸发B. 萃取C. 过滤D. 蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,下列有关物质的用途和原理分析正确的是
选项 | 物质的用途 | 原理和分析 |
A | 漂白粉可用于食品漂白 | 漂白粉能使色素褪色 |
B | Al(OH)3可中和胃酸 | Al(OH)3是两性氢氧化物,与酸发生中和反应 |
C | Na2O2常作供氧化 | Na2O2在常温下能分解放出O2 |
D | 明矾可作净水剂 | 明矾溶于水后能消毒杀菌 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习兴趣小组讨论辨析以下说法,其中说法正确的是
A. 碱性氧化物一定是金属氧化物
B. 酸性氧化物一定不能和酸反应
C. 通过化学变化可以实现16O与18O间的相互转化
D. 混合物:氯水、氨水、水玻璃、水银、福尔马林、淀粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将晶体X加热分解,可得A,B,D,E,F和水六种产物,其中A,B,D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式 .
(2)B,D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在周期表中的位置是 .
(3)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的化学方程式为 , 制得的气体可用如图所示装置收集,则气体应从(填“A”或“B”)通入.
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为 , 若向X的浓溶液中滴加浓NaOH溶液至过量,现象依次为、、 .
(5)取一定量的X晶体分解,若生成F 1mol,则必同时生成物质mol. 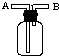
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一小块钠暴露在空气中一段时间,发生的反应是
①4Na+O2═2Na2O ②2Na+O2═Na2O2
③Na2O+H2O═2NaOH ④2NaOH+CO2═Na2CO3+H2O
A. ① B. ②④ C. ①③ D. ①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com