
【题目】下列反应属于吸热反应的是( )
A.炭燃烧生成一氧化碳
B.中和反应
C.锌粒与稀硫酸反应制取H2
D.Ba(OH)28H2O与NH4Cl反
应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向含溶质0.2mol的Al2(SO4)3溶液中加入1000mL KOH溶液,生成白色沉淀7.8g ,则KOH溶液的物质的量浓度可能为
A.0.3mol/L B.0.7mol/L C.0.8 mol/L D.1.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题:
(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.
①滴定管如图所示,用(填“甲”或“乙”)滴定管盛待测定的未知浓度的盐酸溶液.
②用滴定的方法来测定盐酸的浓度,实验数据如表所示:
实验编号 | 待测盐酸溶液的体积/mL | 滴入NaOH溶液的体积/mL |
1 | 20.00 | 23.00 |
2 | 20.00 | 23.10 |
3 | 20.00 | 22.90 |
该未知盐酸的浓度为(保留两位有效数字).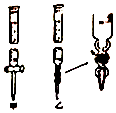
(2)若用酚酞作指示剂,达到滴定终点的标志是 .
(3)造成测定结果偏高的操作可能是 .
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的读数时,滴定前仰视凹液面最低处,滴定后俯视读数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下几种物质①熔融氯化钠 ②浓硫酸 ③Cu ④蔗糖 ⑤CH3COOH ⑥酒精 ⑦液溴,填空回答:(填序号)
(1)以上物质中属于强电解质的是 ;属于非电解质的是 ;
(2)写出⑤在水中的电离方程式: ;
(3)写出②与③共热时的化学反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是:
A. 150 mL 1 mol·L-1 的NaCl B. 75 mL 2 mol·L-1 的NH4Cl
C. 150 mL 3 mol·L-1 的KCl D. 75 mL 2 mol·L-1 的CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁(FePO42H2O,难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料.实验室可通过下列实验制备磷酸铁.
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤.反应加热的目的是 .
(2)向滤液中加入一定量H2O2氧化Fe2+ . 为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+ , 离子方程式如下:Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O
①在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、和 .
②若滴定x mL滤液中的Fe2+ , 消耗a molL﹣1K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=molL﹣1 .
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是(填选项字母).
A.加入适当过量的H2O2溶液 B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行 D.用氨水调节溶液pH=7
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO42H2O.若反应得到的FePO42H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为 .
(4)磷酸亚铁锂LiFePO4是一种新型汽车锂电池,总反应为FePO4+Li ![]() LiFePO4 , 电池中的固体电解质可传导离子,放电时,正极反应为: .
LiFePO4 , 电池中的固体电解质可传导离子,放电时,正极反应为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2SO4、NaCl、NaOH的混合溶液中,含有Na+、SO42-、OH-的个数比是8∶1∶2,则溶液中Na2SO4、NaCl、NaOH的物质的量之比是
A. 1∶1∶1B. 1∶2∶4C. 1∶3∶2D. 1∶4∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度不变恒容的容器中0.1molL﹣1H2进行反应H22H,若某段时间内H2浓度由0.06molL﹣1降到0.036molL﹣1所需的反应时间为12s,则反应起始时H2浓度由0.1molL﹣1降到0.06molL﹣1需的时间为( )
A.等于24s
B.等于20s
C.大于20s
D.小于20s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将晶体X加热分解,可得A,B,D,E,F和水六种产物,其中A,B,D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式 .
(2)B,D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在周期表中的位置是 .
(3)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的化学方程式为 , 制得的气体可用如图所示装置收集,则气体应从(填“A”或“B”)通入.
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为 , 若向X的浓溶液中滴加浓NaOH溶液至过量,现象依次为、、 .
(5)取一定量的X晶体分解,若生成F 1mol,则必同时生成物质mol. 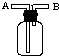
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com