
【题目】(1)写出下列物质在水溶液中的电离方程式:
CH3COOH____HClO4_____
Fe(OH)3____Ba(OH)2_____
NaHSO4____
(2)常温下2.3g乙醇和一定量的氧气混合,点燃恰好完全燃烧,生成液态水和CO2放出68.35kJ热量,则该反应的热化学方程式为:___。
(3)根据下列热化学方程式分析,C(s)的燃烧热△H等于___。
C(s)+H2O(l)=CO(g)+H2(g) △H1=+175.3kJ·mol-1
2CO(g) + O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g) + O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
【答案】CH3COOH![]() CH3COO-+H+ HClO4=H++ ClO4- Fe(OH)3
CH3COO-+H+ HClO4=H++ ClO4- Fe(OH)3![]() Fe3++3OH- Ba(OH)2=Ba2++2OH- NaHSO4=Na++H++SO42- C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=1367kJ/mol C(s)+O2(g)=CO2(g) △H3=-393.5kJ·mol-1
Fe3++3OH- Ba(OH)2=Ba2++2OH- NaHSO4=Na++H++SO42- C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=1367kJ/mol C(s)+O2(g)=CO2(g) △H3=-393.5kJ·mol-1
【解析】
在五种物质中,HClO4、Ba(OH)2、NaHSO4为强电解质,在水溶液中完全电离;CH3COOH、Fe(OH)3为弱电解质,在水溶液中部分电离。强电解质中间用“=”,弱电解质中间用“![]() ”。
”。
(1) CH3COOH 在水溶液中发生部分电离,电离方程式为CH3COOH![]() CH3COO-+H+,答案为CH3COOH
CH3COO-+H+,答案为CH3COOH![]() CH3COO-+H+;
CH3COO-+H+;
HClO4为强酸,在水溶液中完全电离,电离方程式为HClO4=H++ ClO4-,答案为HClO4=H++ ClO4-;
Fe(OH)3为弱碱,在水溶液中部分电离,电离方程式为Fe(OH)3![]() Fe3++3OH-,答案为Fe(OH)3
Fe3++3OH-,答案为Fe(OH)3![]() Fe3++3OH-;
Fe3++3OH-;
Ba(OH)2为强碱,在水溶液中完全电离,电离方程式为Ba(OH)2=Ba2++2OH-,答案为Ba(OH)2=Ba2++2OH-;
NaHSO4为强酸的酸式盐,在溶液中完全电离,电离方程式为NaHSO4=Na++H++SO42-,答案为NaHSO4=Na++H++SO42-;
(2) 2.3g乙醇为0.05mol,燃烧后放热68.35kJ;则1mol乙醇完全燃烧放热1367kJ,该反应的热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=1367kJ/mol,答案为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=1367kJ/mol;
(3) C(s)+H2O(l)=CO(g)+H2(g) △H1=+175.3kJ·mol-1 ①
2CO(g) + O2(g)=2CO2(g) △H2=-566.0kJ·mol-1 ②
2H2(g) + O2(g)=2H2O(l) △H3=-571.6kJ·mol-1 ③
根据盖斯电离,将[①×2+②+③]/2得:C(s)+O2(g)=CO2(g) △H3=-393.5kJ·mol-1,答案为:C(s)+O2(g)=CO2(g) △H3=-393.5kJ·mol-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知同温度同浓度时,下列微粒的电离程度由大到小的顺序是H2CO3>H2S>HCO![]() >HS-,则下列说法正确的是( )
>HS-,则下列说法正确的是( )
A.氢硫酸的酸性强于碳酸B.反应Na2CO3+H2S = NaHCO3+NaHS能够发生
C.CO![]() 结合H+的能力强于S2-D.同温度时,同浓度的NaHS的pH大于Na2S
结合H+的能力强于S2-D.同温度时,同浓度的NaHS的pH大于Na2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的实线表示元素周期表的边界。①~⑧分别表示元素周期表中对应位置的元素。
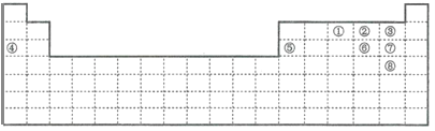
(1)元素周期表体现了元素周期律。元素周期律的本质是________。在元素周期表中,元素的位置与结构的关系是______。
(2)在上表中画出金属区和非金属区的分界线_______
(3)上述元素所能形成的简单离子中半径最小的是________(填离子符号),最高价氧化物对应水化物酸性最强的是________(填分子式)。
(4)④与⑥形成的化合物溶于水后,溶液的pH________7。原因________________(用离子方程式表示),若使其熔化,需破坏的作用力有________________。
(5)元素①的氢化物电子式为________________,该分子属于________晶体。
(6)⑥⑦两元素非金属性较强的是(写元素符号)________。写出能证明这一结论的一个实验事实____。
(7)⑤、⑦各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为____。
(8)⑦的氢化物的还原性比元素⑥的氢化物的还原性________(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种固定烟气中CO2的工艺流程如下:
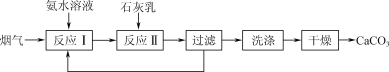
(1) “反应Ⅰ”中,CO2与过量氨水反应的离子方程式为________。
(2) “反应Ⅰ”中,提高烟气中CO2去除率的可行措施有________(填字母)。
a. 采用高温 b. 加快烟气流速 c. 增大氨水浓度
(3) 若测得滤液中c(CO32-)=10-2 mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。[c(Ca2+)<10-5 mol·L-1时视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4) “反应Ⅱ”中,溶液的pH和导电能力变化如图1所示,导电能力初始时快速降低,后来逐渐上升的原因是____________________________________________。
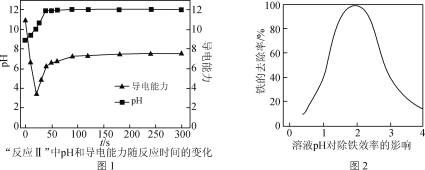
(5) CaCO3可用于调节废水的pH,以除去其中的Fe3+。溶液pH对除铁效率影响如图2所示。
①除铁时应控制溶液的pH为________(填字母)。
a. 0.5~1.5 b. 1.5~2.5 c. 2.5~3.5
② 除铁时pH稍大会生成Fe(OH)3胶体,显著降低除铁效率,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某科研机构设计如图装置,利用K2Cr2O7实现含苯酚废水的有效处理,一段时间后,中间室中NaCl溶液的浓度减小。下列说法正确的是( )
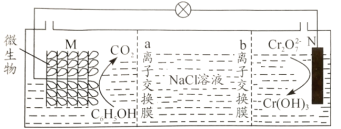
A.M为该电池的正极
B.该装置在高温下处理含苯酚废水效果更佳
C.a为阳离子交换膜,b为阴离子交换膜
D.N电极反应式为:Cr2O![]() +6e-+8H+=2Cr(OH)3↓+H2O
+6e-+8H+=2Cr(OH)3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的原料,含有的主要元素是硫、铁、铜,请回答下列问题。
(l)基态硫原子中核外电子有____种空间运动状态。Fe2+的电子排布式是 ___。
(2)液态SO2可发生白偶电离2SO2=SO2++SO32-,SO32-的空间构型是 ___,与SO2+互为等电子体的分子有____(填化学式,任写一种)。
(3)CuCl熔点为426℃,融化时几乎不导电,CuF的熔点为908℃,沸点1100℃,都是铜(I)的卤化物,熔沸点相差这么大的原因是 ___。
(4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是____。乙硫醇的沸点比乙醇的沸点____(填“高”或“低”),原因是____。
(5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是 ___,其密度为 ___g/cm3(阿伏加德罗常数的值用NA表示)。
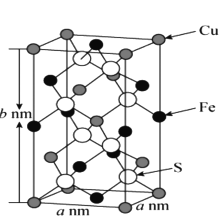
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X(g)+3Y(g) ![]() 2Z(g) ΔH=-a kJ·molˉ1 ,一定条件下,将1 mol X和3 mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4 mol。下列说法正确的是( )
2Z(g) ΔH=-a kJ·molˉ1 ,一定条件下,将1 mol X和3 mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4 mol。下列说法正确的是( )
A.10min内,消耗0.2 mol X,生成0.4 mol Z
B.第10min时,X的反应速率为0.01 mol·Lˉ1·minˉ1
C.10min内,Y的平均反应速率为0.03 mol·Lˉ1·sˉ1
D.10min内,X和Y反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
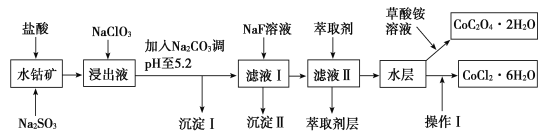
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | 开始沉淀 | 完全沉淀 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Co(OH)2 | 7.6 | 9.2 |
Al(OH)3 | 4.0 | 5.2 |
Mn(OH)2 | 7.7 | 9.8 |
(1)浸出过程中氧化剂与还原剂物质的量之比为___。
(2)NaClO3在浸出液中发生反应的离子方程式为___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为__。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___、___、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
温度范围/℃ | 150~210 | 290~320 |
固体质量/g | 4.41 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为___。[已知:CoC2O4·2H2O的摩尔质量为183g·mol-1]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com