
【题目】下图中的实线表示元素周期表的边界。①~⑧分别表示元素周期表中对应位置的元素。
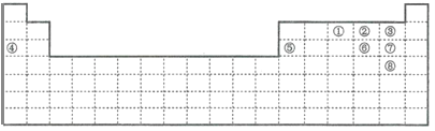
(1)元素周期表体现了元素周期律。元素周期律的本质是________。在元素周期表中,元素的位置与结构的关系是______。
(2)在上表中画出金属区和非金属区的分界线_______
(3)上述元素所能形成的简单离子中半径最小的是________(填离子符号),最高价氧化物对应水化物酸性最强的是________(填分子式)。
(4)④与⑥形成的化合物溶于水后,溶液的pH________7。原因________________(用离子方程式表示),若使其熔化,需破坏的作用力有________________。
(5)元素①的氢化物电子式为________________,该分子属于________晶体。
(6)⑥⑦两元素非金属性较强的是(写元素符号)________。写出能证明这一结论的一个实验事实____。
(7)⑤、⑦各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为____。
(8)⑦的氢化物的还原性比元素⑥的氢化物的还原性________(填“强”或“弱”)。
【答案】原子核外电子排布的周期性变化; 元素的周期数即为原子的电子层数,元素的主族序数即为原子的最外层电子数 ![]()
![]()
![]() >
> ![]()
![]() 、
、![]()
![]() 离子键
离子键 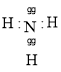 分子晶体 Cl 氯气通入
分子晶体 Cl 氯气通入![]() 溶液中产生淡黄色沉淀(合理即可)
溶液中产生淡黄色沉淀(合理即可) ![]() 弱
弱
【解析】
由元素在元素周期表中的位置可知,①为N,②为O,③为F,④为Na,⑤为Al,⑥为S,⑦为Cl,⑧为Br,然后利用元素及其单质、化合物的性质进行解答。
由元素在元素周期表中的位置可知,①为N,②为O,③为F,④为Na,⑤为Al,⑥为S,⑦为Cl,⑧为Br,
(1)元素周期律的本质为元素原子核外电子排布的周期性变化引起元素性质的周期性变化;在元素周期表中,元素的位置与结构的关系为元素的周期数即为原子的电子层数,元素的主族序数即为原子结构的最外层电子数;
故答案为:原子核外电子排布的周期性变化;元素的周期数即为原子的电子层数,元素的主族序数即为原子的最外层电子数;
(2)金属区和非金属区的分界线如图所示:
![]() ;
;
故答案为:![]() ;
;
(3)上述元素中N、O、F、Na、Al形成的简单离子核外电子排布相同,核电荷数越大,半径越小,则Al3+离子半径最小,Al3+核外电子层数为2,S2-、Cl-核外电子层数为3,Br-核外电子层数为4,因此上述元素所能形成的简单离子中半径最小的是Al3+;非金属元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,而同周期从左至右非金属性逐渐增强,同主族从上至下非金属逐渐减弱,因此Cl的非金属性最强,则其最高价氧化物对应水化物的酸性最强,为![]() ;
;
故答案为:![]() ;
;![]() ;
;
(4)④为Na,⑥为S,④与⑥形成的化合物为Na2S,其溶于水后,由于S2-水解使溶液呈碱性,则溶液的pH>7,S2-水解的离子方程式可表示为:![]()
![]() 、
、![]()
![]() ;Na2S为离子化合物,若使其熔化,需破坏的作用力为离子键;
;Na2S为离子化合物,若使其熔化,需破坏的作用力为离子键;
故答案为:>;![]()
![]() 、
、![]()
![]() ;离子键;
;离子键;
(5)①为N,N元素的氢化物为NH3,其为共价化合物,原子之间通过共用电子对形成相互作用力,则电子式为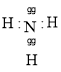 ;该分子属于分子晶体;
;该分子属于分子晶体;
故答案为: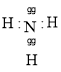 ;分子晶体;
;分子晶体;
(6)⑥为S,⑦为Cl,同周期元素从左至右非金属逐渐增强,则非金属性较强的为Cl;可从它们的非金属单质之间的置换反应比较元素非金属性的强弱,例如,可将氯气通入![]() 溶液中产生淡黄色沉淀,说明氯气的氧化性大于硫的氧化性,则非金属性:Cl>S;
溶液中产生淡黄色沉淀,说明氯气的氧化性大于硫的氧化性,则非金属性:Cl>S;
故答案为:Cl;氯气通入![]() 溶液中产生淡黄色沉淀(合理即可);
溶液中产生淡黄色沉淀(合理即可);
(7)⑤为Al,⑦为Cl,其最高价氧化物对应的水化物分别为Al(OH)3、HClO4,二者发生酸碱中和反应,反应的离子方程式为![]() ;
;
故答案为:![]() ;
;
(8)⑥为S,⑦为Cl,非金属性越强,其氢化物的还原性越弱,而非金属:Cl>S,则HCl的还原性比H2S的还原性弱;
故答案为:弱。


科目:高中化学 来源: 题型:
【题目】Ca(NO2)2(亚硝酸钙)是易溶于水的无色晶体,可用作混凝土中钢筋的防护剂。
(1)Ca(NO2)2的制备方法很多。
①实验室可用反应Ca(NO3)2+2CaFe2O4+4NO![]() 3Ca(NO2)2+2Fe2O3制备Ca(NO2)2,该反应中被氧化的N原子与被还原的N原子的物质的量之比为_____。
3Ca(NO2)2+2Fe2O3制备Ca(NO2)2,该反应中被氧化的N原子与被还原的N原子的物质的量之比为_____。
②用石灰乳吸收硝酸工业尾气中氮氧化物制备Ca(NO2)2,其中NO2与Ca(OH)2反应生成Ca(NO2)2和Ca(NO3)2的化学方程式为_____,经过滤得到含Ca(NO2)2的溶液为液态产品。
(2)测定某液态产品中NO3-含量的步骤如下:
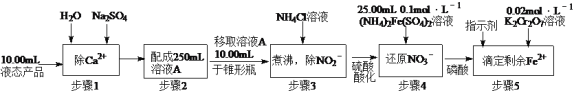
已知:步骤4中的反应为NO3—+3Fe2++4H+=3Fe3++NO↑+2H2O,
步骤5中的反应为6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O。
若步骤5滴定至终点时消耗K2Cr2O7溶液20.00mL,计算液态产品中NO3-的含量(单位g·L-1,最后结果保留一位小数,写出计算过程)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KMnO4氧化盐酸溶液,反应方程式如2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,计算:
(1)参加反应的HCl的物质的量________________
(2)反应中被氧化的HCl的物质的量__________________
(3)并用双线桥标出电子转移的方向和数目___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用如图装置探究SO2和Fe(NO3)3溶液的反应原理。下列说法错误的是( )
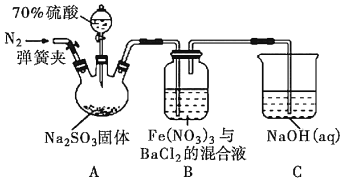
A.装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO![]()
B.实验室中配制加70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C.三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D.装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不用任何试剂,只用试管和胶头滴管就可以鉴别开来的一组是:(1)![]() 溶液和
溶液和![]() 溶液(2)NaOH溶液和
溶液(2)NaOH溶液和![]() 溶液(3)HCl溶液和
溶液(3)HCl溶液和![]() 溶液(4)
溶液(4)![]() 溶液和氨水溶液
溶液和氨水溶液
A.(1)(2)(3)B.(2)(3)(4)C.(1)(2)D.(2)(3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增加,且均不超过20。W、X、Y最外层电子数之和为15,![]() 是实验室常用的一种化学试剂。下列说法中错误的是( )
是实验室常用的一种化学试剂。下列说法中错误的是( )
A.Z2Y的水溶液呈碱性
B.最简单氢化物沸点高低为:X>W
C.常见单质的氧化性强弱为:W>Y
D.![]() 中各原子最外层均满足8电子稳定结构
中各原子最外层均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:

(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质在水溶液中的电离方程式:
CH3COOH____HClO4_____
Fe(OH)3____Ba(OH)2_____
NaHSO4____
(2)常温下2.3g乙醇和一定量的氧气混合,点燃恰好完全燃烧,生成液态水和CO2放出68.35kJ热量,则该反应的热化学方程式为:___。
(3)根据下列热化学方程式分析,C(s)的燃烧热△H等于___。
C(s)+H2O(l)=CO(g)+H2(g) △H1=+175.3kJ·mol-1
2CO(g) + O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g) + O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)表示核素的符号共______种。
(2)互为同位素的是________________。
(3)质量相同的H216O和D216O所含中子数之比为________。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2[Be(OH)4]的离子方程式:__________________
(5)Be(OH)2与Mg(OH)2可用____________________试剂鉴别。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com