
【题目】下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)表示核素的符号共______种。
(2)互为同位素的是________________。
(3)质量相同的H216O和D216O所含中子数之比为________。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2[Be(OH)4]的离子方程式:__________________
(5)Be(OH)2与Mg(OH)2可用____________________试剂鉴别。
【答案】6 ![]() C
C ![]() C 8∶9 Be+2OH-+2H2O===[Be(OH)4]2-+H2↑ NaOH溶液
C 8∶9 Be+2OH-+2H2O===[Be(OH)4]2-+H2↑ NaOH溶液
【解析】
(1)具有一定质子数和中子数的原子是核素;
(2)质子数相同,中子数不同的同种元素的不同原子互为同位素,质量数=质子数+中子数;
(3)H2O与D2O的摩尔质量分别为18g/mol、20g/mol,二者分子中分别含有中子数为8、10;
(4)元素周期表中,处于对角线位置的元素具有相似的性质,则根据铝的单质的性质可推断铍与氢氧化钠的反应;
(5)氢氧化铍与氢氧化铝性质相似,能和氢氧化钠反应,而Mg(OH)2和氢氧化钠不反应。
(1)具有一定质子数和中子数的原子是核素,![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,均为核素,所以一共有6种核素,168O2、168O3为单质;
,均为核素,所以一共有6种核素,168O2、168O3为单质;
(2)![]() 、146C质子数相同而中子数不同的同一元素的不同原子互称同位素;
、146C质子数相同而中子数不同的同一元素的不同原子互称同位素;
(3)质量相同的H2O与D2O的物质的量与摩尔质量成反比,二者物质的量之比=20g/mol:18g/mol=10:9,所含的中子数之比=(10×8):(9×10)=8:9;
(4)金属铍与铝的单质及其化合物性质相似,则Be与NaOH溶液反应生Na2[Be(OH)4]和氢气,离子反应为:Be+2OH-+2H2O=[Be(OH)4]2-+H2↑;
(5)氢氧化铍与氢氧化铝性质相似,能和氢氧化钠反应,而Mg(OH)2和氢氧化钠不反应,则选NaOH溶液鉴别,离子反应为Be(OH)2+2OH-=BeO22-+2H2O。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下图中的实线表示元素周期表的边界。①~⑧分别表示元素周期表中对应位置的元素。
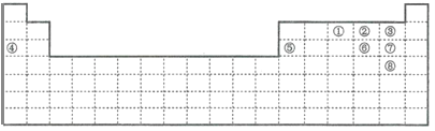
(1)元素周期表体现了元素周期律。元素周期律的本质是________。在元素周期表中,元素的位置与结构的关系是______。
(2)在上表中画出金属区和非金属区的分界线_______
(3)上述元素所能形成的简单离子中半径最小的是________(填离子符号),最高价氧化物对应水化物酸性最强的是________(填分子式)。
(4)④与⑥形成的化合物溶于水后,溶液的pH________7。原因________________(用离子方程式表示),若使其熔化,需破坏的作用力有________________。
(5)元素①的氢化物电子式为________________,该分子属于________晶体。
(6)⑥⑦两元素非金属性较强的是(写元素符号)________。写出能证明这一结论的一个实验事实____。
(7)⑤、⑦各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为____。
(8)⑦的氢化物的还原性比元素⑥的氢化物的还原性________(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的原料,含有的主要元素是硫、铁、铜,请回答下列问题。
(l)基态硫原子中核外电子有____种空间运动状态。Fe2+的电子排布式是 ___。
(2)液态SO2可发生白偶电离2SO2=SO2++SO32-,SO32-的空间构型是 ___,与SO2+互为等电子体的分子有____(填化学式,任写一种)。
(3)CuCl熔点为426℃,融化时几乎不导电,CuF的熔点为908℃,沸点1100℃,都是铜(I)的卤化物,熔沸点相差这么大的原因是 ___。
(4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是____。乙硫醇的沸点比乙醇的沸点____(填“高”或“低”),原因是____。
(5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是 ___,其密度为 ___g/cm3(阿伏加德罗常数的值用NA表示)。
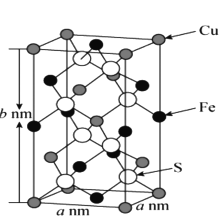
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X(g)+3Y(g) ![]() 2Z(g) ΔH=-a kJ·molˉ1 ,一定条件下,将1 mol X和3 mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4 mol。下列说法正确的是( )
2Z(g) ΔH=-a kJ·molˉ1 ,一定条件下,将1 mol X和3 mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4 mol。下列说法正确的是( )
A.10min内,消耗0.2 mol X,生成0.4 mol Z
B.第10min时,X的反应速率为0.01 mol·Lˉ1·minˉ1
C.10min内,Y的平均反应速率为0.03 mol·Lˉ1·sˉ1
D.10min内,X和Y反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验。
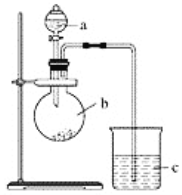
(1)仪器a的名称是________,应盛放下列药品中的________(填字母)。
A.稀硫酸 B.亚硫酸C.氢硫酸 D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________(填字母)。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是________,如果看到的现象是____________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力________比________强,b中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目;W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强。
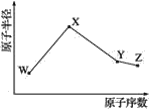
(1)Y在周期表中的位置是__。
(2)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种制氢技术原理如图所示,下列说法正确的是( )
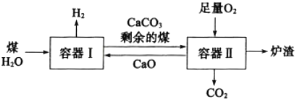
A.向容器Ⅰ中加入CaO能有效实现H2与CO2的分离
B.因为容器Ⅰ中还有剩余的煤,可以判断煤和H2O的反应为可逆反应
C.剩余的煤进入容器Ⅱ,可利用其与O2反应放出的热量分解CaCO3
D.煤中含有的硫元素在容器Ⅱ中最终转化为CaSO3进入炉渣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
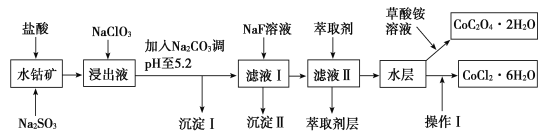
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | 开始沉淀 | 完全沉淀 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Co(OH)2 | 7.6 | 9.2 |
Al(OH)3 | 4.0 | 5.2 |
Mn(OH)2 | 7.7 | 9.8 |
(1)浸出过程中氧化剂与还原剂物质的量之比为___。
(2)NaClO3在浸出液中发生反应的离子方程式为___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为__。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___、___、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
温度范围/℃ | 150~210 | 290~320 |
固体质量/g | 4.41 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为___。[已知:CoC2O4·2H2O的摩尔质量为183g·mol-1]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为正盐。根据下列变化进行推断,回答有关问题:

(1)推断A、B、C、D的化学式:A________、B________、C________、D________。
(2)写出下列反应的离子方程式:
反应①生成气体B:__________________________________________________;
反应②白色沉淀溶解:________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com