
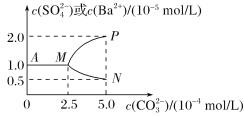
【题目】常温下,将0.1 mol BaSO4粉末置于盛有500 mL蒸馏水的烧杯中,然后烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是( )
A. 相同温度时,Ksp(BaSO4)>Ksp(BaCO3)
B. BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大
C. 反应BaSO4(s)+CO32- (aq) ![]() BaCO3(s)+SO42- (aq),该反应的正反应平衡常数K1大于其逆反应的平衡常数K2
BaCO3(s)+SO42- (aq),该反应的正反应平衡常数K1大于其逆反应的平衡常数K2
D. 若使0.1 mol BaSO4全部转化为BaCO3,至少要加入2.6 mol Na2CO3
【答案】D
【解析】
A、根据图像,可以计算 Ksp(BaSO4)、Ksp(BaCO3);
B、BaSO4在BaCl2溶液中由于Ba2+的存在,使沉淀溶解平衡向生成沉淀方向移动,因此在BaCl2溶液中的溶解度变小,Ksp只随温度的改变而改变。
C. 反应BaSO4(s)+CO32- (aq) ![]() BaCO3(s)+SO42- (aq),正反应平衡常数K1=
BaCO3(s)+SO42- (aq),正反应平衡常数K1=![]() ,逆反应平衡常数K2=
,逆反应平衡常数K2=![]() ;
;
D使0.1molBaSO4转化为BaCO3,发生的反应为BaSO4(s)+CO32-(aq) ![]() BaCO3(s)+SO42- (aq),根据平衡常数计算至少要加入Na2CO3的物质的量。
BaCO3(s)+SO42- (aq),根据平衡常数计算至少要加入Na2CO3的物质的量。
A、根据图像,CO32-浓度为0时,c(Ba2+)、c(SO42-)都是1![]() ,所以 Ksp(BaSO4)= 1
,所以 Ksp(BaSO4)= 1![]() ,碳酸钡饱和溶液中当c(CO32-)= 5
,碳酸钡饱和溶液中当c(CO32-)= 5![]() 时,c(Ba2+)=0.5
时,c(Ba2+)=0.5![]() , Ksp(BaCO3)= 2.5
, Ksp(BaCO3)= 2.5![]() ,相同温度时,Ksp(BaSO4)<Ksp(BaCO3),故A错误;
,相同温度时,Ksp(BaSO4)<Ksp(BaCO3),故A错误;
B、BaSO4在BaCl2溶液中由于Ba2+的存在,使沉淀溶解平衡向生成沉淀方向移动,因此在BaCl2溶液中的溶解度变小,Ksp只随温度的改变而改变,无论在水中还是BaCl2溶液中,Ksp值是不变的,故B错误;
C. 反应BaSO4(s)+CO32- (aq) ![]() BaCO3(s)+SO42- (aq),正反应平衡常数K1=
BaCO3(s)+SO42- (aq),正反应平衡常数K1=![]() ,逆反应平衡常数K2=
,逆反应平衡常数K2=![]() ,根据A选项,Ksp(BaSO4)<Ksp(BaCO3),所以K1<1、K2>1,故C错误;
,根据A选项,Ksp(BaSO4)<Ksp(BaCO3),所以K1<1、K2>1,故C错误;
D、使0.1molBaSO4转化为BaCO3,发生的反应为BaSO4+CO32-![]() BaCO3+SO42-,根据图象,Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9,反应的平衡常数K1=
BaCO3+SO42-,根据图象,Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9,反应的平衡常数K1=![]() =0.04,若使0.1molBaSO4全部转化为BaCO3,则反应生成0.1molSO42-,
=0.04,若使0.1molBaSO4全部转化为BaCO3,则反应生成0.1molSO42-,![]() ═K=0.04,则平衡时n(CO32-)=2.5mol,则至少需要Na2CO3的物质的量为2.5mol+0.1mol=2.6mol,故D正确。
═K=0.04,则平衡时n(CO32-)=2.5mol,则至少需要Na2CO3的物质的量为2.5mol+0.1mol=2.6mol,故D正确。


科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,按要求回答问题:
① |
| ||||||||||||||||
|
|
| ② | ③ | ④ |
|
| ||||||||||
⑤ | ⑥ |
|
|
|
|
|
|
|
|
|
| ⑦ |
|
| ⑧ | ⑨ |
|
(1)元素④在周期表中位置是_______。元素③的最高价氧化物的化学式为________。
(2)元素①⑤组成化合物电子式为___________。
(3)元素②的单质与⑧的最高价氧化物的水化物热的浓溶液反应的化学方程式为___。
(4)元素⑦与⑨形成的化合物与元素③的氢化物的水溶液反应的离子方程式为_____。
(5)元素④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为_____(用离子符号表示)。
(6)A—F发生如图所示的转化,A、B、C、D为①—⑨中某种元素形成的单质,E、F、G为B、C、D与A形成的二元化合物,G是一种常见温室气体,与B可以反应生成E,E中B元素的质量分数为60%,F为两性物质。

①A和F的化学式分别为_______、_______。
②B与G反应的化学方程式为____________________。
③C与NaOH溶液反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:

注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入2mL甲苯和一定量其它试剂,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。

(1)装置a的名称是_____,主要作用是________。三颈瓶中发生反应的化学方程式为_______。
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是_________。
(3)反应完毕,反应混合液经过自然冷却至室温后,还应经过__________、________(填操作名称)等操作,才能得到苯甲醛粗产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的实验步骤是______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.与适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸(相对分子质量为122)产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000 mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为_______(保留一位小数)。下列情况会使测定结果偏低的是____(填字母)。
a.滴定终了俯视读取数据 b.KOH标准液长时间接触空气
c.配制KOH标准液时仰视定容 d.将指示剂换为甲基橙溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置,电极I为Al,其他电极均为Cu,下列说法正确的是

A. 盐桥中通常装有含琼脂的KCl饱和溶液,起作用是平衡电荷,电池工作时,K+、Cl-会分别进入两边的溶液中
B. 该装置工作一段时间后,电极III上有红色固体析出
C. 该装置工作一段时间后,③号烧杯中电解质溶液浓度不变,两个电极的质量不变
D. 该装置工作时,③号烧杯中的SO42-向电极IV移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质结构、性质的说法中正确的是( )

①烃的密度比水的密度小
②C2H6、C4H10、C6H14在常温下均为气体
③1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有3个碳碳双键
④水芹烯(桂皮中的一种成分)键线式如图,其分子式为C10H16
⑤![]() 互为同系物
互为同系物
⑥甲烷与氯气在光照的条件下可以制取纯净的一氯甲烷
⑦C5H12有三种同分异构体
A. ①②⑤ B. ③④⑦ C. ③⑤⑥ D. ①④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的产量通常用来衡量一个国家的石油化工发展水平。下图是以A为原料进行有机合成的一种路线。
已知:2RCHO+O2![]() 2RCOOH。
2RCOOH。
请回答下列问题

(1)B、D分子内含有的官能团分别是____________、____________(填名称)。
(2)写出下列反应的反应类型:①______________,④______________。
(3)E能与金属钠反应且分子中只含有一个甲基,则E的结构简式为:__________________。
(4)G有多种同分异构体,其中一类含有![]() 结构,但不能跟碳酸氢钠反应,请写出符合条件的G的所有同分异构体的结构简式:__________________________________________________。
结构,但不能跟碳酸氢钠反应,请写出符合条件的G的所有同分异构体的结构简式:__________________________________________________。
(5)写出下列反应的化学方程式(注明反应条件)
②_______________________________________________________;
④____________________________________________________;
⑤____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高校的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示,下列说法正确的是( )

A. 该装置可以将太阳能转化为电能
B. 阴极的电极反应式为3CO2+4e—=C+2CO32—
C. 高温的目的只是为了将碳酸盐熔融,提供阴阳离子
D. 电解过程中电子由负极流向阴极,经过熔融盐到阳极,最后回到正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某溶液中所含离子的鉴别,下列判断正确的是
A.加入AgNO3溶液生成白色沉淀,可确定有Cl-
B.加入BaCl2溶液生成白色沉淀,加稀盐酸沉淀不溶解,可确定有SO42-
C.某黄色溶液加CCl4,振荡、静置,下层溶液显紫红色,可确定有I2存在
D.加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种常见元素,其中X、Y、Z为短周期元素。有关信息如下表。

(1)Z的氧化物在通讯领域用来作__。
(2)X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为__。一种含X元素的化合物是家用消毒液的有效成分,它能有效杀灭2019-coVn,请写出工业上制备它的离子反应方程式__,但在使用时特别注意不能与洁厕灵混用,原因是__(用化学方程式表示)。
(3)W在周期表中的位置为__,聚硅酸W是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废W渣(主要成分W3O4,含少量碳及二氧化硅)为原料制备的流程如图:

①加热条件下酸浸时,W3O4与硫酸反应生成W的离子。
②酸浸时,通入O2的目的是___。
③“W3+浓度检测”是先将100mL含W3+溶液用适量的SnCl2还原为W2+;再用酸性K2Cr2O7标准溶液测定W2+的量(Cr2O72-被还原为Cr3+),此时发生反应的离子方程式___,若用掉0.2mol·L-1K2Cr2O7溶液50mL,则W3+浓度为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com