
【题目】关于某溶液中所含离子的鉴别,下列判断正确的是
A.加入AgNO3溶液生成白色沉淀,可确定有Cl-
B.加入BaCl2溶液生成白色沉淀,加稀盐酸沉淀不溶解,可确定有SO42-
C.某黄色溶液加CCl4,振荡、静置,下层溶液显紫红色,可确定有I2存在
D.加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-
科目:高中化学 来源: 题型:
【题目】NO2和N2O4的相互转化2NO2(g)![]() N2O4(g)是高中乃至大学讨论化学平衡问题的常用体系。请回答:
N2O4(g)是高中乃至大学讨论化学平衡问题的常用体系。请回答:
Ⅰ. 将N2O4 (g)转化为N2O4(l),可用来制备硝酸。
(1)已知2NO2(g)![]() N2O4(g) △H1 2NO2(g)
N2O4(g) △H1 2NO2(g)![]() N2O4(l) △H2
N2O4(l) △H2
下列能量变化示意图正确的是____________。
A. 
B. 
C. 
(2)NO2和N2O4物质的量之比为1:1与O2和H2O恰好完全反应的化学方程式为_____。
Ⅱ. 对于2NO2(g)![]() N2O4(g)反应体系,标准平衡常数Kθ=
N2O4(g)反应体系,标准平衡常数Kθ= ,其中Pθ为标准压强(1×105 Pa),P(N2O4)和P(NO2)为各组分平衡分压(平衡分压=总压×物质的量分数)。
,其中Pθ为标准压强(1×105 Pa),P(N2O4)和P(NO2)为各组分平衡分压(平衡分压=总压×物质的量分数)。
(1)若起始NO2的物质的量设为1mol,反应在恒定温度和标准压强下进行,N2O4的平衡产率为0.75,则Kθ=____________。
(2)利用现代手持技术传感器可以探究压强对2NO2 (g) ![]() N2O4 (g)化学平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
N2O4 (g)化学平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。

①B点时NO2的转化率为____________。
②E、H两点对应气体的平均相对分子质量ME __________MH(填“<、>或=”)。
Ⅲ. 已知反应:2NO(g)+O2(g)![]() 2NO2(g)是通过下面两步完成的:
2NO2(g)是通过下面两步完成的:
反应①:2NO(g)![]() N2O2(g) △H1<0(快) v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g) △H1<0(快) v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
反应②:N2O2(g)+O2(g)![]() 2NO2(g) △H2<0(慢) v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g) △H2<0(慢) v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
某科研小组测量出反应②的部分实验数据如下表所示:
c(N2O2)/ mol/L | c(O2)/ mol/L | ν2正/ mol·L-1·s-1 |
0.010 | 0.010 | 1.75×10-6 |
0.030 | 0.020 | 1.05×10-5 |
x | 0.060 | 1.05×10-5 |
(1)根据上表中的有关数据计算:x=________。
(2)若①、②两反应的正、逆反应速率常数分别用k1正、k2逆、k2正、k2逆表示,则2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K=____(用速率常数表示);反应达到平衡后升高温度,在新平衡建立前,体系内c(N2O2)的大小变化趋势是逐渐_____。
2NO2(g)的平衡常数K=____(用速率常数表示);反应达到平衡后升高温度,在新平衡建立前,体系内c(N2O2)的大小变化趋势是逐渐_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1 mol BaSO4粉末置于盛有500 mL蒸馏水的烧杯中,然后烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是( )
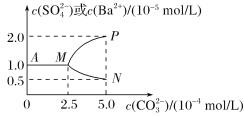
A. 相同温度时,Ksp(BaSO4)>Ksp(BaCO3)
B. BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大
C. 反应BaSO4(s)+CO32- (aq) ![]() BaCO3(s)+SO42- (aq),该反应的正反应平衡常数K1大于其逆反应的平衡常数K2
BaCO3(s)+SO42- (aq),该反应的正反应平衡常数K1大于其逆反应的平衡常数K2
D. 若使0.1 mol BaSO4全部转化为BaCO3,至少要加入2.6 mol Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含有大量PbI2的饱和溶液中存在平衡:PbI2(s)![]() Pb2+(aq)+2I-(aq),向该饱和溶液中加入KI浓溶液,下列说法正确的是
Pb2+(aq)+2I-(aq),向该饱和溶液中加入KI浓溶液,下列说法正确的是
A. 溶液中Pb2+和I-的浓度都增大 B. PbI2的溶度积常数Ksp增大
C. 沉淀溶解平衡向右移动 D. 溶液中Pb2+的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或实验操作正确的是

A. ①用pH试纸测某溶液的酸碱性 B. ②探究氧化性:KMnO4>Cl2>I2
C. ③吸收氨气制氨水 D. ④中和滴定实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列物质 ①NaCl晶体②液态SO2 ③纯醋酸 ④硫酸钡⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KNO3 ⑧NaOH溶液 ⑨氨水 请用以上物质的序号回答下列问题:
属于强电解质的是________; 属于弱电解质的是_______;在上述状态下能导电的物质是_________。
(2)化学平衡移动原理同样也适用于其它平衡,已知在氨水中存在下列平衡:NH3·H2O ![]() NH4++OH-
NH4++OH-
①向氨水中加入NH4Cl固体时,平衡____________移动,(填“向右”或“向左”),c(OH-)____(填“增大”或“减小”,下同)。
②向氨水中加入MgCl2固体时,平衡_____移动,(填“向右”或“向左”), c(NH4+)____(填“增大”或“减小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是镁——次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含![]() 的工业废水的处理。下列说法正确的是( )
的工业废水的处理。下列说法正确的是( )

A. 图乙中![]() 向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B. 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
C. 图乙电解池中,若有0.84g阳极材料参与反应,则阴极会有3.36L的气体产生
D. 若图甲燃料电池消耗0.36g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为测定未知浓度的盐酸溶液,实验如下:用1.00 mL待测盐酸配制100 mL稀盐酸,以0.10 mol/L的NaOH溶液滴定25.00 mL上述稀盐酸,滴定终止时消耗NaOH溶液15.00mL。
(1)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果______(填“偏大”、“偏小”或“无影响”,下同);若观察碱式滴定管读数时,滴定前仰视而滴定后俯视,则结果会导致测得的稀盐酸溶液浓度值_________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入下图中的________(选填“甲”或“乙”);下图在滴定操作时,排去碱式滴定管中气泡的方法应采用操作______(选填“甲”、“乙”或“丙”),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)配制100 mL一定浓度的稀盐酸溶液,除使用量筒、烧杯、玻璃棒、和胶头滴管外还需用到的仪器是______________,计算待测盐酸(稀释前的盐酸)溶液的物质的量浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )

A. 滤纸上c点附近会变红色
B. Cu电极质量减小,Pt电极质量增大
C. Z中溶液的pH先减小,后增大
D. 溶液中的SO42-向Cu电极定向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com