
【题目】下列所得到的四种溶液,其百分比浓度由大到小排列的是( )
(1)7.5克胆矾溶于100克水中
(2)5.1克氢氧化钙放入100克水中
(3)50克8%氢氧化钠溶液加入50克水
(4)配制20℃的高锰酸钾饱和溶液(20℃时高锰酸钾溶解度为6.4克)
A.(4)(2)(3)(1)B.(4)(1)(3)(2)C.(1)(4)(3)(2)D.(1)(4)(2)(3)
科目:高中化学 来源: 题型:
【题目】往FeBr2溶液中通入Cl2时,随参加反应Cl2物质的量的变化,溶液中某些离子的浓度变化情况如图所示。下列说法不正确的是

A.当n(Cl2)<M mol时,发生的离子反应:2Fe2++Cl2=2Fe3++2Cl―
B.当n(Cl2)=M mol时,离子浓度关系:c(Fe3+)︰c(Br-)︰c(Cl-)=1︰2︰2
C.当n(Cl2)=2M mol时,离子浓度大小关系:c(Cl-)>c(Br-)
D.当Br―开始被氧化时,通入Cl2的物质的量小于原FeBr2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图所示的四个原电池装置,其中结论正确的是( )
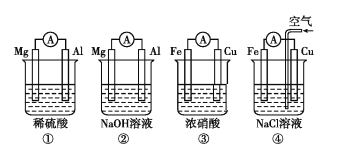
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑
C.③中Fe作负极,电极反应式为Fe-3e-=Fe3+
D.④中Cu作正极,电极反应式为2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知五种元素的原子序数的大小顺序为 C>A>B>D>E,A、C同周期,B、C 同主族;A与B形成离子化合物,![]() 中所有的离子的电子数相同, 其电子总数为 30;D 和 E 可形成 5核10电子的分子。试回答下列问题:
中所有的离子的电子数相同, 其电子总数为 30;D 和 E 可形成 5核10电子的分子。试回答下列问题:
(1)写出下列物质的电子式:
![]() 的电子式:____________________;A、B、E形成的化合物:____________________;
的电子式:____________________;A、B、E形成的化合物:____________________;
(2)A、B 两元素组成的化合物![]() 存在的化学键是__________________________________。
存在的化学键是__________________________________。
(3)写出 D 和 E 形成的 5 核 10 电子分子与氯气的第一步反应的方程式:___________________________________________________。
Ⅱ.对下列物质进行分类(均填序号)。互为同素异形体的是________________;互为同分异构体的是________________;互为同系物的是________________.
①![]() 和
和![]() ;②
;②![]() 与
与![]() ;③
;③![]() 和
和![]() ;④金刚石与水晶; ⑤正戊烷和异戊烷 ⑥
;④金刚石与水晶; ⑤正戊烷和异戊烷 ⑥![]() 和
和 ![]() ⑦
⑦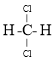
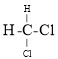 ;⑧
;⑧![]() 与
与![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中能量变化如图所示(图中E表示正反应的活化能,E2表示逆反应的活化能。下列有关叙述正确的是
2SO3(g)反应过程中能量变化如图所示(图中E表示正反应的活化能,E2表示逆反应的活化能。下列有关叙述正确的是
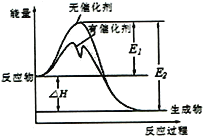
A. 该反应的逆反应为放热反应,升高温度可提高活化分子的百分数
B. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
C. 该反应中,反应物的总键能大于生成物的总键能
D. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH =-2akJ·mol-1
2SO3(g) ΔH =-2akJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HClO4、H2SO4、HNO3和HCl都是强酸,它们的酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
下列说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO![]()
D.水不能区分这四种酸的强弱,但冰醋酸可以区分这四种酸的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G为七种短周期主族元素,原子序数依次增大。已知:A、F的最外层电子数分别等于各自的电子层数,其中A的单质在常温下为气体。C与B、G在元素周期表中处于相邻位置,这三种元素原子的最外层电子数之和为17,质子数之和为31。D与F同周期,且在该周期中D元素的原子半径最大。根据以上信息回答下列问题:
(1)B、C、G的氢化物中稳定性最强的是__________(填化学式),G的某种氧化物能使溴水褪色,写出该反应的化学方程式__________________________________________。
(2)B、C、D、E、F形成的简单离子半径由大到小的顺序为__________________(用离子符号表示)。
(3)A与B能形成离子化合物A5B,A5B中既含离子键又含共价键,其电子式为________,该物质能与水剧烈反应生成两种气体,这两种气体的化学式是__________。
(4)D、A、C和碳元素组成的化合物的水溶液呈________性,用离子方程式解释其原因________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为 2NO2(g)+O3(g) ![]() N2O5(g)+O2(g)。有关说法正确的是( )
N2O5(g)+O2(g)。有关说法正确的是( )
A. 增大压强可增大反应速率 B. 升高温度可减小反应速率
C. 达到平衡时,v(正)=v(逆)=0 D. 达到平衡时,NO2转化率为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示;下列描述错误的是:

A. 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法
B. 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品
C. 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小
D. 用SO2水溶液吸收Br2的离子反应方程式为:Br2+SO2+2H2O═4H++SO42﹣+2Br﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com