
 按照题目的要求,回答下列有关题:
按照题目的要求,回答下列有关题:| △c |
| △t |
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| △c(H2) |
| △t |
| ||
| tB |
| nB |
| 3tB |
| nB |
| 3tB |


科目:高中化学 来源: 题型:
A、 定量测定化学反应速率 |
B、 验证钠与水反映的热效应 |
C、 加热d即可进行乙醇的催化氧化实验 |
D、 比较Fe3+和Cu2+对H2O2分解的催化效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
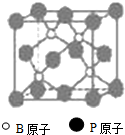 (物质结构与性质)磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.
(物质结构与性质)磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)北京奥运会的“祥云”火炬所用燃料主要是丙烷,若以硫酸溶液为电解质溶液,两极分别通入丙烷和空气,形成燃料电池,则反应总方程式为
(1)北京奥运会的“祥云”火炬所用燃料主要是丙烷,若以硫酸溶液为电解质溶液,两极分别通入丙烷和空气,形成燃料电池,则反应总方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、构成原电池正极和负极的材料必须是两种金属 |
| B、在该原电池中,铜作负极 |
| C、铜锌原电池工作时,若有13g锌溶解,则电路中就有0.4mol电子通过 |
| D、电子通过硫酸溶液由锌流向铜,在铜电极上被氢离子得到而放出氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com