


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
| A、金属钠着火时,用大量水进行灭火 |
| B、铝制餐具可代替铁制餐具长时间存放酸性、碱性食物 |
| C、在50mL量筒中配制0.1mol?L-1碳酸钠溶液 |
| D、易燃、易爆药品与有强氧化性的物质要分开放置并远离火源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L乙醇含有的分子数为0.5NA |
| B、常温常压下,22 g CO2含有的原子数为1.5NA |
| C、12 g 金属镁变成镁离子时失去的电子数为0.5NA |
| D、0.1mol?L-1Na2SO4溶液中含有的钠离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n | B、2n | C、3n | D、4n |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加水 |
| B、加热 |
| C、加CH3COONa固体 |
| D、加很稀的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度.COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量.某学习小组用重铬酸钾法测定某水样中的COD.主要的实验装置、仪器及具体操作步骤如下:实验装置及仪器:
浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度.COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量.某学习小组用重铬酸钾法测定某水样中的COD.主要的实验装置、仪器及具体操作步骤如下:实验装置及仪器: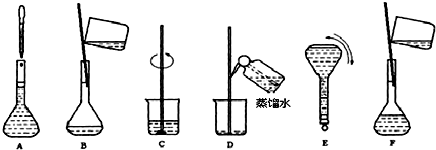
查看答案和解析>>
科目:高中化学 来源: 题型:
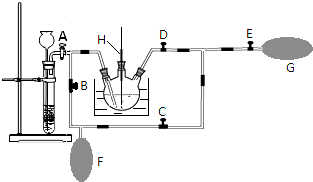 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com