
 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH
| ||
| 5 |
| 2 |
| 500mL |
| 25mL |
| 6.32g |
| 7.245g |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用钠、镁分别与水反应,可证明钠、镁的金属性强弱 |
| B、用氯化镁、氯化铝分别与过量浓氨水反应,可证明镁、铝的金属性强弱 |
| C、用铁、石墨与硫酸铜溶液组成原电池,可证明铁、铜的金属性强弱 |
| D、把氯气通入到硫化钠的水溶液中,看到淡黄色沉淀,可证明氯气、硫的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:

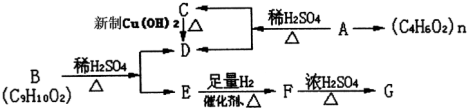
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内压强不随时间的变化而变化 |
| B、容器内A、B、C、D四者共存 |
| C、A、D的消耗速率相等 |
| D、C、D的生成速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
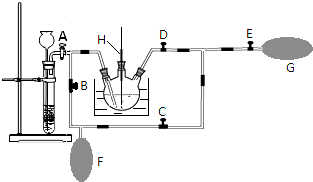
 用如图所示装置(夹持仪器已省略)进行实验,E为分液漏斗活塞.将液体A逐滴加入到固体B 中,请回答下列问题:
用如图所示装置(夹持仪器已省略)进行实验,E为分液漏斗活塞.将液体A逐滴加入到固体B 中,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH2=CH2 |
| B、CH3CH=CH2 |
| C、CH3CH3 |
| D、CH3CH2CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com