
【题目】已知反应![]() 是可逆反应.设计如图装置
是可逆反应.设计如图装置![]() 、
、![]() 均为石墨电极
均为石墨电极![]() ,分别进行下述操作.
,分别进行下述操作.
I向B烧杯中逐滴加入浓盐酸
![]() 向B烧杯中逐滴加入
向B烧杯中逐滴加入![]() 溶液结果发现电流计指针均发生偏转.
溶液结果发现电流计指针均发生偏转.
据此,下列判断正确的是![]()
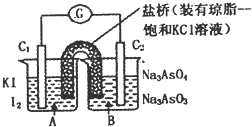
A.操作I过程中,![]() 为正极
为正极
B.操作II过程中,盐桥中的![]() 移向B烧杯溶液
移向B烧杯溶液
C.I操作过程中,![]() 棒上发生的反应为:
棒上发生的反应为:![]()
D.II操作过程中,![]() 棒上发生的反应为:
棒上发生的反应为:![]()
科目:高中化学 来源: 题型:
【题目】对于反应A2+3B2![]() 2AB3 以下表示的反应速率中,速率最大的是( )
2AB3 以下表示的反应速率中,速率最大的是( )
A. V(A2)=0.4 molL-1min-1 B. V(B2)=0.8 molL-1min-1
C. V(AB3)=0.6 molL-1min-1 D. V(A2)=0.01 molL-1S-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
A.KClO3在反应中失去电子B.ClO2是氧化产物
C.H2C2O4在反应中被氧化D.1mol KClO3参加反应有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20℃时,两种气态烃和氧气的混合物装入密闭容器中点燃爆炸,又恢复到20℃,此时容器中气体压强为反应前的一半,用氢氧化钠溶液吸收后容器内几乎真空,此两种烃可能是( )
A.CH4 C6H12B.CH4 C3H4C.C2H6 C3H8D.C6H6 C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。下列装置是用燃烧法确定有机物分子式常用的装置。

(1)B装置中浓H2SO4的作用是____________________
(2)装置D中所盛固体可以是__________(用对应符号填空)
a.生石灰 b. CaCl2 c. CuSO4 d. 碱石灰
(3)C中燃烧管中CuO的作用是_____________________________;
(4)F中干燥管中碱石灰的作用是___________________________;
(5)当C中有机物完全反应后还要继续通一段时间的氧气目的是____________;
(6)若准确称取0.90g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,E管质量增加1.32g,D管质量增加0.54 g,经测定该有机物的质谱图中最大质荷比为60.0,该有机物的分子式为_________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ·mol1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH=-QkJ·mol1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是

A. 图Ⅰ研究的是t1时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ研究的是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的描述正确的是( )
A.淀粉、油脂、氨基酸在一定条件下都能水解
B.石油的分馏、煤的液化与气化都是物理变化
C.甲烷与氯气混合光照后,气体颜色变浅,容器内出现油状液滴和白雾
D.苯甲酸的结构简式为![]() ,官能团为羧基和碳碳双键
,官能团为羧基和碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(s,石墨) = C(s,金刚石) ΔH=+1.9kJ/mol可知,金刚石比石墨稳定
C.在101kPa、25℃时,H2的燃烧热为ΔH= —285.8kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g) = 2H2O(g) ΔH= —285.8kJ/mol
D.稀溶液中:H+(aq)+OH-(aq) = H2O(l) ΔH= —57.3kJ/mol ,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将![]() 和
和![]() 转化成难溶弱酸盐。
转化成难溶弱酸盐。
已知:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)将SrSO4转化成SrCO3的离子方程式为:_______________________________________,该反应的平衡常数表达式为_____________________________________;该反应能发生的原因是:________________________________。(用沉淀溶解平衡的有关理论解释)
(2)对于上述反应,实验证明增大CO32-的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”):
①升高温度,平衡常数K将__________________________________;
②增大CO32-的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrSO4。实验所用的试剂为________;实验现象及其相应结论为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com