
【题目】在20℃时,两种气态烃和氧气的混合物装入密闭容器中点燃爆炸,又恢复到20℃,此时容器中气体压强为反应前的一半,用氢氧化钠溶液吸收后容器内几乎真空,此两种烃可能是( )
A.CH4 C6H12B.CH4 C3H4C.C2H6 C3H8D.C6H6 C2H2
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是( )
A.H2S 的电离方程式:H2S+H2O![]() H3O++HS-
H3O++HS-
B.NaHCO3在水溶液中的电离方程式:NaHCO3===Na++H++CO32-
C.NaHSO4在水溶液中的电离方程式:NaHSO4===Na++HSO42-
D.NaHSO4在熔融状态的电离方程式:NaHSO4===Na++H++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】文献表明:工业上,向炽热铁屑中通入HCl生产无水FeCl2;相同条件下,草酸根(C2O42-)的还原性强于Fe2+。某化学研究性小组进行以下实验检验这一结论并测定三草酸合铁酸钾晶体[K3Fe(C2O4)3xH2O]中草酸根含量和结晶水含量。用如图所示装置制取无水FeCl2
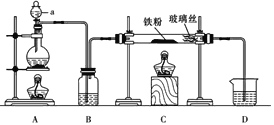
(1)仪器a的名称为___________,B中的试剂为___________。
(2)欲制得纯净的FeCl2,实验过程需先点燃A处酒精灯,原因是__________________。
(3)若用D的装置进行尾气处理,存在的问题是_______________、_________________。
(4)某小组设计使用如图装置直接比较Fe2+和C2O42-的还原性强弱,并达到了预期的目的。
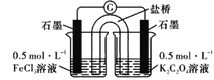
左池石墨电极为_________极,写出右池电极反应式:_______________。
(5)为测定三草酸合铁酸钾晶体中草酸根的含量和结晶水的含量,进行了如下实验:
滴定过程:①称量m g三草酸合铁酸钾晶体样品,配制成250mL溶液。
②取所配溶液25.00mL于锥形瓶中,滴加酸性KMnO4溶液滴定,恰好消耗V mL a molL-1KMnO4溶液。C2O42-被全部转化的现象是__________。
③该晶体中C2O42-的质量分数为_____________。
误差若盛放酸性KMnO4溶液的滴定管未用标准液润洗,会使结晶水x的数值_______。(填“偏高”“偏低”“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.铜作电极材料电解饱和食盐水时总反应为:2H2O+2Cl―![]() Cl2↑+ H2↑+2OH―
Cl2↑+ H2↑+2OH―
B.铅蓄电池充电时阳极反应式为:PbSO4–2e-+2H2O=PbO2+4H++SO42―
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu–2e-=Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe–2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为研究电化学原理,使用KCl盐桥设计如图所示实验装置.下列分析不合理的是![]()
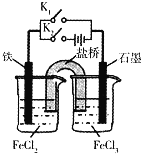
A.闭合![]() 断开
断开![]() ,左侧烧杯中的
,左侧烧杯中的![]() 向铁电极移动
向铁电极移动
B.无论闭合![]() ,断开
,断开![]() ,还是断开
,还是断开![]() ,闭合
,闭合![]() ,石墨电极上发生的反应都是
,石墨电极上发生的反应都是![]()
C.闭合![]() ,断开
,断开![]() ,电流从石墨电极经过
,电流从石墨电极经过![]() 流向铁电极
流向铁电极
D.闭合![]() ,断开
,断开![]() ,左侧烧杯中的溶液pH将逐渐降低
,左侧烧杯中的溶液pH将逐渐降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片插入同浓度的稀硫酸中一段时间,下列叙述正确的是![]()

A.甲中铜片是正极,乙中铜片是负极
B.甲中铜被氧化,乙中锌被氧化
C.甲中锌片上的反应为:![]()
D.两烧杯中铜片表面均无气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]() 是可逆反应.设计如图装置
是可逆反应.设计如图装置![]() 、
、![]() 均为石墨电极
均为石墨电极![]() ,分别进行下述操作.
,分别进行下述操作.
I向B烧杯中逐滴加入浓盐酸
![]() 向B烧杯中逐滴加入
向B烧杯中逐滴加入![]() 溶液结果发现电流计指针均发生偏转.
溶液结果发现电流计指针均发生偏转.
据此,下列判断正确的是![]()
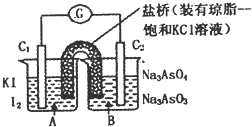
A.操作I过程中,![]() 为正极
为正极
B.操作II过程中,盐桥中的![]() 移向B烧杯溶液
移向B烧杯溶液
C.I操作过程中,![]() 棒上发生的反应为:
棒上发生的反应为:![]()
D.II操作过程中,![]() 棒上发生的反应为:
棒上发生的反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个化学反应,我们不但要关心物质变化,还要研究能量变化和反应快慢。
(1)下面是一个由天然气和水反应制备氢气的反应,其方程式为:CH4(g)+ 2H2O(g) ![]() CO2(g)+4H2(g)该反应过程中能量变化如图所示,则该反应为______反应(填“吸热”或“放热”),
CO2(g)+4H2(g)该反应过程中能量变化如图所示,则该反应为______反应(填“吸热”或“放热”),
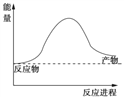
若已知,破坏1mol化学键需要吸收的热量如下表所示:则该反应吸收或放出热量为______kJ (用含a b c d字母的代数式表示)。
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | a | b | c | d |
(2)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为________;X为__________。若反应经2min达到平衡,平衡时C的浓度______0.8mol/L(填“大于”,“小于”或“等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为__________。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为________;X为__________。若反应经2min达到平衡,平衡时C的浓度______0.8mol/L(填“大于”,“小于”或“等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用标准NaOH溶液滴定充满HCl的烧瓶(标况下,烧瓶容积为V L)做完喷泉实验后得到的稀盐酸(水充满整个烧瓶)以测定它的准确浓度,用酚酞作指示剂。请你回答下列问题:
(1)计算该盐酸的物质的量浓度为:_____。(保留三位有效数字)
(2)现有三种浓度的标准NaOH溶液,你认为最合适的是下列第_____种。
①5.00molL﹣1②0.500molL﹣1③0.0500molL﹣1
(3)若采用上述最合适浓度的标准NaOH溶液滴定,滴定时实验数据列表如下:
实验次数编号 | 待测盐酸体积(mL) | 滴入NaOH溶液体积(mL) |
1 | 10.00 | 8.48 |
2 | 10.00 | 8.52 |
3 | 10.00 | 8.00 |
求这种待测稀盐酸的物质的量浓度c(HCl)=_____。与理论计算值比较,造成的误差的原因可能是哪些下列操作导致的_____
①滴定前平视,滴定终了俯视
②滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡
③滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗
④看到颜色变化后立即读数 ⑤洗涤锥形瓶时,误把稀食盐水当做蒸馏水进行洗涤
II.测定绿矾FeSO4·xH2O中结晶水含量
Ⅰ.准确称量27.8 g绿矾样品,配成250 mL溶液;
Ⅱ.量取25.00 mL所配制的溶液于锥形瓶中;
Ⅲ.用硫酸酸化的0.100 0 mol·L1 KMnO4溶液滴定至终点;
Ⅳ.重复操作3次,消耗KMnO4溶液的体积分别为20.02 mL、24.98 mL、19.98 mL。
(1)判断达到滴定终点时的实验现象是_____。
(2)根据实验记录,计算绿矾化学式中结晶水数目x=__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com