
【题目】文献表明:工业上,向炽热铁屑中通入HCl生产无水FeCl2;相同条件下,草酸根(C2O42-)的还原性强于Fe2+。某化学研究性小组进行以下实验检验这一结论并测定三草酸合铁酸钾晶体[K3Fe(C2O4)3xH2O]中草酸根含量和结晶水含量。用如图所示装置制取无水FeCl2
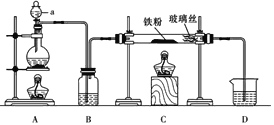
(1)仪器a的名称为___________,B中的试剂为___________。
(2)欲制得纯净的FeCl2,实验过程需先点燃A处酒精灯,原因是__________________。
(3)若用D的装置进行尾气处理,存在的问题是_______________、_________________。
(4)某小组设计使用如图装置直接比较Fe2+和C2O42-的还原性强弱,并达到了预期的目的。
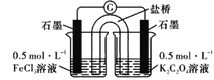
左池石墨电极为_________极,写出右池电极反应式:_______________。
(5)为测定三草酸合铁酸钾晶体中草酸根的含量和结晶水的含量,进行了如下实验:
滴定过程:①称量m g三草酸合铁酸钾晶体样品,配制成250mL溶液。
②取所配溶液25.00mL于锥形瓶中,滴加酸性KMnO4溶液滴定,恰好消耗V mL a molL-1KMnO4溶液。C2O42-被全部转化的现象是__________。
③该晶体中C2O42-的质量分数为_____________。
误差若盛放酸性KMnO4溶液的滴定管未用标准液润洗,会使结晶水x的数值_______。(填“偏高”“偏低”“无影响”)
【答案】分液漏斗 浓硫酸 用HCl排尽装置中的空气,防止铁被氧化,使产品不纯 发生倒吸 可燃性气体H2不能被吸收 正 C2O42— —2e— = 2CO2↑ 溶液由无色转变为浅紫红色,且30秒内不再变化 ![]() 偏低
偏低
【解析】
由装置图可知,在装置C中,铁与HCl发生反应生成FeCl2和氢气,则装置A用于产生HCl,可用氯化钠固体与浓硫酸加热反应制取HCl气体,通过浓硫酸干燥HCl,因加热时铁粉易被空气中的氧气氧化,且反应生成氢气,因此需先点燃A处的酒精灯排尽装置中的空气,再点燃装置C处的酒精灯,尾气的成分是剩余的HCl和生成的氢气,HCl极易溶解于水,氢气不能溶于水,导气管直接插入D装置容易引起倒吸;
(4)图示装置直接比较Fe2+和C2O42-的还原性强弱,并达到了预期的目的,证明了相同条件下,草酸根(C2O42-)的还原性强于Fe2+,根据原电池原理以及氧化还原反应进行分析;
(5)②向所配溶液中滴加酸性KMnO4溶液进行滴定时,KMnO4与C2O42-发生氧化还原反应,要说明C2O42-被全部转化,即说明KMnO4溶液过量;
③KMnO4与C2O42-发生氧化还原反应,满足关系式2MnO4-~5C2O42-,列比例计算C2O42-的质量,进而计算C2O42-的质量分数;分析若盛放酸性KMnO4溶液的滴定管未用标准液润洗,对于C2O42-含量的影响,进而分析对结晶水含量的影响。
由装置图可知,在装置C中,铁与HCl发生反应生成FeCl2和氢气,则装置A用于产生HCl,可用氯化钠固体与浓硫酸加热反应制取HCl气体,通过浓硫酸干燥HCl,因加热时铁粉易被空气中的氧气氧化,因此需先点燃A处的酒精灯排尽装置中的空气,再点燃装置C处的酒精灯,尾气的成分是剩余的HCl和生成的氢气,HCl极易溶解于水,氢气不能溶于水,导气管直接插入D装置容易引起倒吸,
(1)仪器a为分液漏斗;B中的试剂为浓硫酸,用来干燥HCl;故答案为:分液漏斗;浓硫酸;
(2)因加热时铁粉易被空气中的氧气氧化生成铁的氧化物,因此欲制得纯净的FeCl2,实验过程需先点燃A处酒精灯,用HCl排尽装置中的空气;故答案为:用HCl排尽装置中的空气,防止铁被氧化,使产品不纯;
(3)尾气的成分是剩余的HCl和生成的氢气,HCl极易溶解于水,导气管直接插入D装置中容易发生倒吸,且氢气不能溶于水,不能被吸收;故答案为:发生倒吸;可燃性气体H2不能被吸收;
(4)某小组设计使用如图装置直接比较Fe2+和C2O42-的还原性强弱,并达到了预期的目的,证明了相同条件下,草酸根(C2O42-)的还原性强于Fe2+,则该原电池反应为2Fe3++C2O42- =2Fe2++2CO2↑;则Fe3+作氧化剂得电子,被还原,则左池石墨电极为正极,右池石墨电极为负极,电极反应式为C2O42- -2e- = 2CO2↑;故答案为:正;C2O42- -2e- = 2CO2↑;
(5)②向所配溶液中滴加酸性KMnO4溶液进行滴定时,KMnO4与C2O42-发生氧化还原反应,当加入最后一滴酸性KMnO4溶液时,溶液由无色转变为浅紫红色,且30秒内不再变化,说明KMnO4溶液过量,C2O42-被全部转化;故答案为:溶液由无色转变为浅紫红色,且30秒内不再变化;
③KMnO4与C2O42-发生氧化还原反应,满足关系式2MnO4-~5C2O42-,则25.00mL溶液中![]() ,250mL溶液中n(C2O42-)=0.025aV mol,则该晶体中C2O42-的质量分数为
,250mL溶液中n(C2O42-)=0.025aV mol,则该晶体中C2O42-的质量分数为![]() ;若盛放酸性KMnO4溶液的滴定管未用标准液润洗,KMnO4溶液的浓度会偏小,则滴定C2O42-消耗的酸性KMnO4溶液的体积会偏大,则使得C2O42-的含量偏高,即K3Fe(C2O4)3的含量偏高,晶体质量一定,会使结晶水含量降低,则x的数值偏低;故答案为:
;若盛放酸性KMnO4溶液的滴定管未用标准液润洗,KMnO4溶液的浓度会偏小,则滴定C2O42-消耗的酸性KMnO4溶液的体积会偏大,则使得C2O42-的含量偏高,即K3Fe(C2O4)3的含量偏高,晶体质量一定,会使结晶水含量降低,则x的数值偏低;故答案为:![]() ;偏低。
;偏低。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】某工厂利用褐煤烟灰(主要成分为碳、二氧化锗,还有少量氧化铝和二氧化硅)制取纯GeO2的主要流程如下:
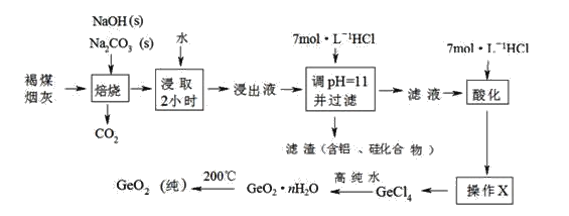
已知:GeO2是一种难溶于水的偏弱酸性的两性氧化物,GeCl4的沸点是83.1℃。
(1)写出二氧化锗与碳酸钠焙烧时发生反应的化学方程式:_______________。
(2)用水浸取焙烧物长达2小时的目的是_______________________。
(3)“酸化”至溶液中盐酸浓度为5.3 mol·L-1时有利于生成四氯化锗,写出该反应的化学方程式:_____________。
(4)若滤液“酸化”时酸度不够,溶液会出现明显的浑浊,原因是_____________________。
(5)操作“X”的名称为________________。
(6)四氯化锗与高纯水反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A2+3B2![]() 2AB3 以下表示的反应速率中,速率最大的是( )
2AB3 以下表示的反应速率中,速率最大的是( )
A. V(A2)=0.4 molL-1min-1 B. V(B2)=0.8 molL-1min-1
C. V(AB3)=0.6 molL-1min-1 D. V(A2)=0.01 molL-1S-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展储氢技术是氢氧燃料电池推广应用的关键.研究表明液氨是一种良好的储氢物质,其储氢容量可达![]()
![]() 质量分数
质量分数![]() 液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.氨气分解反应的热化学方程式如下:
液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.氨气分解反应的热化学方程式如下:![]()
请回答下列问题:
![]() 氨气自发分解的反应条件是 ______ .
氨气自发分解的反应条件是 ______ .
![]() 已知:
已知:![]()
![]()
![]()
![]()
则,反应![]()
![]() 的
的![]() ______ .
______ .
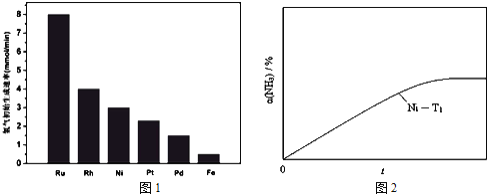
![]() 研究表明金属催化剂可加速氨气的分解.图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率.
研究表明金属催化剂可加速氨气的分解.图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率.
①不同催化剂存在下,氨气分解反应的活化能最大的是 ______ ![]() 填写催化剂的化学式
填写催化剂的化学式![]() .
.
②恒温![]() 恒容时,用Ni催化分解初始浓度为
恒容时,用Ni催化分解初始浓度为![]() 的氨气,并实时监测分解过程中氨气的浓度.计算后得氨气的转化率
的氨气,并实时监测分解过程中氨气的浓度.计算后得氨气的转化率![]() 随时间t变化的关系曲线
随时间t变化的关系曲线![]() 如图
如图![]() 请在图2中画出:在温度为
请在图2中画出:在温度为![]() ,Ru催化分解初始浓度为
,Ru催化分解初始浓度为![]() 的氨气过程中
的氨气过程中![]() 随t变化的总趋势曲线
随t变化的总趋势曲线![]() 标注
标注![]() ______
______
③如果将反应温度提高到![]() ,请如图2中再添加一条Ru催化分解初始浓度为
,请如图2中再添加一条Ru催化分解初始浓度为![]() 的氨气过程中
的氨气过程中![]() 的总趋势曲线
的总趋势曲线![]() 标注
标注![]() ______
______
④假设Ru催化下温度为![]() 时氨气分解的平衡转化率为
时氨气分解的平衡转化率为![]() ,则该温度下此分解反应的平衡常数K与
,则该温度下此分解反应的平衡常数K与![]() 的关系式是:
的关系式是:![]() ______ .
______ .
![]() 用Pt电极对液氨进行电解也可产生
用Pt电极对液氨进行电解也可产生![]() 和
和![]() 阴极的电极反应式是 ______ ;阳极的电极反应式是 ______
阴极的电极反应式是 ______ ;阳极的电极反应式是 ______ ![]() 已知:液氨中
已知:液氨中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年,我国科学家研发出一种新型的锌碘单液流电池,已知M为阴离子交换膜,其原理如图所示。下列说法不正确的是
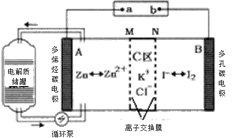
A.放电时A电极反应式为:Zn-2e﹣= Zn2+
B.充电时,B极与外接电源正极相连
C.放电时电解质储罐中离子浓度增大
D.放电时当A极减少65g时,C区Cl﹣增加2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福特公司发明的硫钠电池是一种以金属钠为负极、硫为正极、陶瓷管为电解质隔膜(作用是传递Na+)的二次电池,其原理可以表示为2Na+xS![]() Na2Sx。现将该电池用于电浮选凝聚法对污水进行处理,电源两极分别连接Fe电极和石墨电极,对污水进行处理后,溶液上层有大量的浮渣。下列有关说法错误的是
Na2Sx。现将该电池用于电浮选凝聚法对污水进行处理,电源两极分别连接Fe电极和石墨电极,对污水进行处理后,溶液上层有大量的浮渣。下列有关说法错误的是

A. 硫钠电池放电时正极反应方程式可表示为:xS+2e-+2Na+=Na2Sx
B. Fe电极为电解池阳极,失电了生成亚铁离子,最终会转化为三价铁形成氢氧化铁胶体从而达到净水目的
C. 处理污水时阴极产生的气体可将水中的悬浮物带到水面形成浮渣层,即浮选凝聚
D. 硫钠电池充电时钠离子向阴极移动,每生成1molNa转移xmol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
A.KClO3在反应中失去电子B.ClO2是氧化产物
C.H2C2O4在反应中被氧化D.1mol KClO3参加反应有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20℃时,两种气态烃和氧气的混合物装入密闭容器中点燃爆炸,又恢复到20℃,此时容器中气体压强为反应前的一半,用氢氧化钠溶液吸收后容器内几乎真空,此两种烃可能是( )
A.CH4 C6H12B.CH4 C3H4C.C2H6 C3H8D.C6H6 C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(s,石墨) = C(s,金刚石) ΔH=+1.9kJ/mol可知,金刚石比石墨稳定
C.在101kPa、25℃时,H2的燃烧热为ΔH= —285.8kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g) = 2H2O(g) ΔH= —285.8kJ/mol
D.稀溶液中:H+(aq)+OH-(aq) = H2O(l) ΔH= —57.3kJ/mol ,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com