
【题目】某工厂利用褐煤烟灰(主要成分为碳、二氧化锗,还有少量氧化铝和二氧化硅)制取纯GeO2的主要流程如下:
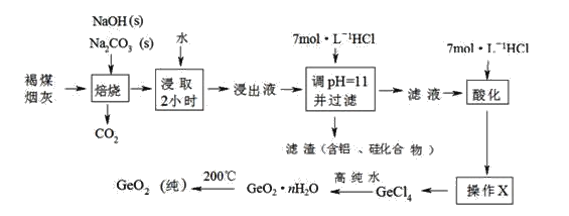
已知:GeO2是一种难溶于水的偏弱酸性的两性氧化物,GeCl4的沸点是83.1℃。
(1)写出二氧化锗与碳酸钠焙烧时发生反应的化学方程式:_______________。
(2)用水浸取焙烧物长达2小时的目的是_______________________。
(3)“酸化”至溶液中盐酸浓度为5.3 mol·L-1时有利于生成四氯化锗,写出该反应的化学方程式:_____________。
(4)若滤液“酸化”时酸度不够,溶液会出现明显的浑浊,原因是_____________________。
(5)操作“X”的名称为________________。
(6)四氯化锗与高纯水反应的化学方程式为__________________。
【答案】Na2CO3+ GeO2![]() Na2GeO3+ CO2↑ 为了提高含锗化合物的浸出率 Na2GeO3+ 6HCl = GeCl4+ 2NaCl + 3H2O 生成了H2GeO3(或GeO2或GeO2·nH2O)沉淀 蒸馏 GeCl4+ (2+n)H2O = GeO2·nH2O +4HCl
Na2GeO3+ CO2↑ 为了提高含锗化合物的浸出率 Na2GeO3+ 6HCl = GeCl4+ 2NaCl + 3H2O 生成了H2GeO3(或GeO2或GeO2·nH2O)沉淀 蒸馏 GeCl4+ (2+n)H2O = GeO2·nH2O +4HCl
【解析】
(1)根据题干信息可以判断:反应物为GeO2、Na2CO3,生成物为Na2GeO3、CO2,反应条件为加热,据此写出反应的化学方程式;
(2)水浸取焙烧物的时间较长,可以使焙烧物中含锗化合物尽可能溶解;
(3)类比偏铝酸钠与盐酸的反应,根据题干信息判断反应物、生成物,然后写出反应的化学方程式;
(4)如果酸度不够,锗酸钠与氢离子反应生成了生成了H2GeO3(或GeO2或GeO2nH2O),生成了H2GeO3(或GeO2或GeO2nH2O)水中溶解度不大,所以出现浑浊现象;
(5)溶液中分离易溶物,可以根据沸点不同利用蒸馏法分离;
(6)根据反应流程可知,四氯化锗与高纯水反应生成GeO2nH2O,根据质量守恒定律写出该反应方程式。
(1)根据反应流程可知,碳酸钠与二氧化锗反应生成锗酸钠和二氧化碳,反应的化学方程式为:GeO2+Na2CO3![]() Na2GeO3+CO2↑;
Na2GeO3+CO2↑;
(2)用水浸取焙烧物长达2小时的目的是为了尽可能使焙烧混合物中的含锗化合物溶于水,=从而提高含锗化合物的浸出率;
(3)GeO2是一种难溶于水的偏弱酸性的两性氧化物,类比氢氧化铝的性质,则H2GeO3能够与氯化氢反应生成生成物为GeCl4、NaCl和水,反应的化学方程式为:Na2GeO3+6HCl=2NaCl+3H2O+GeCl4;
(4)若滤液“酸化”时酸度不够,Na2GeO3与氢离子反应生成了生成了H2GeO3(或GeO2或GeO2nH2O),生成了H2GeO3(或GeO2或GeO2nH2O)在水中溶解度较小,所以溶液会出现明显的浑浊;
(5)GeCl4的沸点是83.1℃,其沸点较低,从溶液中分离出GeCl4,可以通过蒸馏操作操作完成;
(6)根据制备流程可知,GeCl4与高纯水反应生成GeO2nH2O,另一种产物为HCl,则反应的化学方程式为:GeCl4+(2+n)H2O=4HCl+GeO2nH2O。


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】反应2SO2(g)+O2(g) ![]() 2SO3(g)在一容积为2L的密闭容器中进行,试回答:
2SO3(g)在一容积为2L的密闭容器中进行,试回答:
(1)若要加快该反应的反应速率,可采取的措施有____________________、___________________。
(2)开始时,SO2的浓度是2mol/L,O2的浓度是4mol/L,2min内,SO2的浓度减少0.8mol/L,则v(SO2)=_____________。在2min末,SO3的浓度是_______________,O2的浓度是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 0.5 mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出683.4 kJ热量,写出该反应的热化学方程式___________________。
(2)LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)= 2LiH(s) ΔH=-182 kJ·mol-1
②2H2(g)+O2(g)= 2H2O(l) ΔH=-572 kJ·mol-1
③4Li(s)+O2(g)= 2Li2O(s) ΔH=-1 196 kJ·mol-1
试写出LiH在O2中燃烧的热化学方程式__________________。
(3) “长征三号甲”三子级使用的燃料是液氢和液氧,下面是298 K时,氢气(H2)、氧气(O2)有关变化的反应热:
①H2(g)+O2(g)= H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)= H2(l) ΔH=-0.92 kJ·mol-1
③O2(g)= O2(l) ΔH=-6.84 kJ·mol-1
④H2O(g)= H2O(l) ΔH=-44.0 kJ·mol-1
请写出液氢和液氧反应生成气态水的热化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的混合气体在密闭容器中发生如下反应:xA(g)+yB(s)![]() zC(g)。达到平衡后测得A气体的浓度为0.5mol·L-1。当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.2mol·L-1。下列叙述不正确的是( )
zC(g)。达到平衡后测得A气体的浓度为0.5mol·L-1。当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.2mol·L-1。下列叙述不正确的是( )
A.平衡向正反应方向移动B.z<x+y
C.C的体积分数增大D.A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验(a、b两电极均为Cu单质),实验开始观察到灵敏电流计的指针偏转,下列有关说法正确的是( )

A.a极电极反应为Cu2++2e-=CuB.溶液中Cu2+穿过交换膜发生迁移
C.电流计指针偏转幅度将保持不变D.外电路转移的电子最多为0.02mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 ph=5时沉淀完全).其中分析错误的是

A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②可用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 步骤⑤ 的操作为:向漏斗中加入少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是( )
A.H2S 的电离方程式:H2S+H2O![]() H3O++HS-
H3O++HS-
B.NaHCO3在水溶液中的电离方程式:NaHCO3===Na++H++CO32-
C.NaHSO4在水溶液中的电离方程式:NaHSO4===Na++HSO42-
D.NaHSO4在熔融状态的电离方程式:NaHSO4===Na++H++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】文献表明:工业上,向炽热铁屑中通入HCl生产无水FeCl2;相同条件下,草酸根(C2O42-)的还原性强于Fe2+。某化学研究性小组进行以下实验检验这一结论并测定三草酸合铁酸钾晶体[K3Fe(C2O4)3xH2O]中草酸根含量和结晶水含量。用如图所示装置制取无水FeCl2
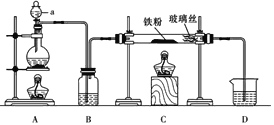
(1)仪器a的名称为___________,B中的试剂为___________。
(2)欲制得纯净的FeCl2,实验过程需先点燃A处酒精灯,原因是__________________。
(3)若用D的装置进行尾气处理,存在的问题是_______________、_________________。
(4)某小组设计使用如图装置直接比较Fe2+和C2O42-的还原性强弱,并达到了预期的目的。
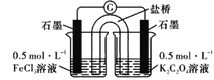
左池石墨电极为_________极,写出右池电极反应式:_______________。
(5)为测定三草酸合铁酸钾晶体中草酸根的含量和结晶水的含量,进行了如下实验:
滴定过程:①称量m g三草酸合铁酸钾晶体样品,配制成250mL溶液。
②取所配溶液25.00mL于锥形瓶中,滴加酸性KMnO4溶液滴定,恰好消耗V mL a molL-1KMnO4溶液。C2O42-被全部转化的现象是__________。
③该晶体中C2O42-的质量分数为_____________。
误差若盛放酸性KMnO4溶液的滴定管未用标准液润洗,会使结晶水x的数值_______。(填“偏高”“偏低”“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com