
【题目】(1) 0.5 mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出683.4 kJ热量,写出该反应的热化学方程式___________________。
(2)LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)= 2LiH(s) ΔH=-182 kJ·mol-1
②2H2(g)+O2(g)= 2H2O(l) ΔH=-572 kJ·mol-1
③4Li(s)+O2(g)= 2Li2O(s) ΔH=-1 196 kJ·mol-1
试写出LiH在O2中燃烧的热化学方程式__________________。
(3) “长征三号甲”三子级使用的燃料是液氢和液氧,下面是298 K时,氢气(H2)、氧气(O2)有关变化的反应热:
①H2(g)+O2(g)= H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)= H2(l) ΔH=-0.92 kJ·mol-1
③O2(g)= O2(l) ΔH=-6.84 kJ·mol-1
④H2O(g)= H2O(l) ΔH=-44.0 kJ·mol-1
请写出液氢和液氧反应生成气态水的热化学方程式:____________。
【答案】C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ/mol 4LiH(s)+2O2(g)=2Li2O(s)+2H2O(l)△H=-1404KJ/mol H2(l)+![]() O2(l)=H2O(g)△H=-237.46KJ/mol
O2(l)=H2O(g)△H=-237.46KJ/mol
【解析】
(1)由0.5 molC2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出683.4 kJ热量可知,1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(l)放出热量为2×683.4 kJ=1366.8kJ;
(2)由盖斯定律可知,将反应②+③-①×2得到LiH在O2中燃烧的热化学方程式;
(3)由盖斯定律可知,将反应①-②-③×![]() +④可得目标反应方程式;
+④可得目标反应方程式;
(1)由0.5 molC2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出683.4 kJ热量可知,1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(l)放出热量为2×683.4 kJ=1366.8kJ,则热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ/mol,故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ/mol;
(2)由盖斯定律可知,将反应②+③-①×2得到LiH在O2中燃烧的热化学方程式4LiH(s)+2O2(g)=2Li2O(s)+2H2O(l),则△H=(-572 kJ·mol-1)+(-1196 kJ·mol-1)—(-182 kJ·mol-1)×2=-1404KJ/mol,则热化学方程式为4LiH(s)+2O2(g)=2Li2O(s)+2H2O(l)△H=-1404KJ/mol,故答案为:4LiH(s)+2O2(g)=2Li2O(s)+2H2O(l)△H=-1404KJ/mol;
(3)由盖斯定律可知,将反应①-②-③×![]() +④可得目标反应方程式H2(l)+
+④可得目标反应方程式H2(l)+![]() O2(l)=H2O(g),其反应热△H=△H1-△H2-△H3×
O2(l)=H2O(g),其反应热△H=△H1-△H2-△H3×![]() +△H4=(-285.8 kJ·mol-1)—(-0.92 kJ·mol-1)—(-6.84 kJ·mol-1)×
+△H4=(-285.8 kJ·mol-1)—(-0.92 kJ·mol-1)—(-6.84 kJ·mol-1)×![]() +(-44.0 kJ·mol-1)=-237.46 kJ/mol,则热化学方程式为H2(l)+
+(-44.0 kJ·mol-1)=-237.46 kJ/mol,则热化学方程式为H2(l)+![]() O2(l)=H2O(g)△H=-237.46KJ/mol,故答案为:H2(l)+
O2(l)=H2O(g)△H=-237.46KJ/mol,故答案为:H2(l)+![]() O2(l)=H2O(g)△H=-237.46KJ/mol。
O2(l)=H2O(g)△H=-237.46KJ/mol。


科目:高中化学 来源: 题型:
【题目】多巴胺是一种神经传导物质,在大脑内传递兴奋的信息,其分子结构如下所示。下列关于多巴胺的说法不正确的是

A. 分子式为C8H11NO2
B. 能与醛类物质发生缩聚反应
C. 既能与酸反应,又能与碱反应
D. 1mol该物质最多能与2mol Br2发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂的变色范围:
指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(1)该实验应选用 作指示剂。
(2)下图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;反应达滴定终点时的现象为 。

(3)为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积;
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液;
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗;
D.锥形瓶预先用食用白醋润洗过;
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C= mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 氢氧燃料电池正极消耗22.4 L气体时,负极消耗的气体分子数目为2NA
B. 2.0gD2O中含有的质子数、电子数均为NA
C. 向含有FeI2的溶液中通入适量氯气,当有1molFe2+被氧化时,该反应转移电子数目一定为3NA
D. 14g分子式为CnH2n的烃中含有的共价键的数目一定为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中不正确的是
A. 14g由N2和13C2H2组成的混合物中,所含中子数为7NA
B. CH4与白磷(P4)都为正四面体结构,则1mol CH4与lmolP4所含共价键的数目均为4NA
C. 反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ/mol,若放出热量4.62kJ,则转移电子的数目为0.3NA
2NH3(g) ΔH=-92.4kJ/mol,若放出热量4.62kJ,则转移电子的数目为0.3NA
D. 常温下,含0.5molNH4NO3与xmolNH3·H2O的中性溶液中,含有NH4+的数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
a.配制![]() 食盐溶液时,将称量的食盐放入烧杯中,加适量的水,搅拌、溶解
食盐溶液时,将称量的食盐放入烧杯中,加适量的水,搅拌、溶解
b.用50mL量筒量取![]() 稀硫酸
稀硫酸
c.用中和滴定法测定某NaOH溶液的浓度时,酸式滴定管需用标准酸液润洗![]() 次
次
d.配制![]() 的
的![]() 溶液时,将量取的浓
溶液时,将量取的浓![]() 注入容量瓶中加水稀释
注入容量瓶中加水稀释
e.用瓷坩埚灼烧各种钠的化合物
f.测定中和反应的反应热时,利用玻璃搅拌器匀速搅拌.
A.adfB.bdeC.acfD.cef
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
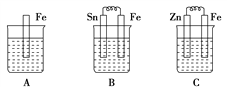
①B中Sn极的电极反应式为_______;Sn极附近溶液的pH(填“增大”、“减小”或“不变”)______。
②C中总反应离子方程式为_______________。
③比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________________。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:
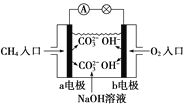
①电池的负极是________(填“a”或“b”)电极,该极的电极反应是:_______________________。
②常温下,如果该原电池电解质溶液为pH=13的氢氧化钠500mL,构成原电池一段时间后pH变为12,则构成原电池消耗了标准状况下__________ mL甲烷,(假设化学能全部转化为电能,忽略氢氧化钠溶液的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂利用褐煤烟灰(主要成分为碳、二氧化锗,还有少量氧化铝和二氧化硅)制取纯GeO2的主要流程如下:
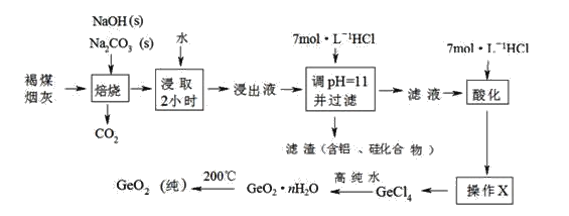
已知:GeO2是一种难溶于水的偏弱酸性的两性氧化物,GeCl4的沸点是83.1℃。
(1)写出二氧化锗与碳酸钠焙烧时发生反应的化学方程式:_______________。
(2)用水浸取焙烧物长达2小时的目的是_______________________。
(3)“酸化”至溶液中盐酸浓度为5.3 mol·L-1时有利于生成四氯化锗,写出该反应的化学方程式:_____________。
(4)若滤液“酸化”时酸度不够,溶液会出现明显的浑浊,原因是_____________________。
(5)操作“X”的名称为________________。
(6)四氯化锗与高纯水反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A2+3B2![]() 2AB3 以下表示的反应速率中,速率最大的是( )
2AB3 以下表示的反应速率中,速率最大的是( )
A. V(A2)=0.4 molL-1min-1 B. V(B2)=0.8 molL-1min-1
C. V(AB3)=0.6 molL-1min-1 D. V(A2)=0.01 molL-1S-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com