
【题目】A的产量可以用于衡量一个国家的石油化工发展水平。B和D是生活中两种常见的有机物,D是食醋的主要成分。相互转化关系如图所示。
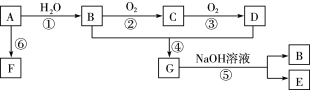
(1)A的结构简式是______,D中官能团名称是:______。
(2)在制备G的实验中,反应条件是_____,为了除去产物中的杂质所用的试剂是_____。
(3)用于鉴别A和甲烷的一种试剂是________。
(4)写出下列反应的化学方程式:①:__________,④:________________。
【答案】CH2=CH2 羧基 浓硫酸、加热 饱和碳酸钠溶液 酸性高锰酸钾溶液或溴的四氯化碳溶液 CH2=CH2+H2O![]() CH3CH2OH CH3COOH+C2H5OH
CH3CH2OH CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
【解析】
A的产量可以用于衡量一个国家的石油化工发展水平,则A为CH2=CH2;A与H2O发生加成反应生成的B为CH3CH2OH,B与O2反应生成的C为CH3CHO,C与O2反应生成的D为CH3COOH,B与D反应生成的G为CH3COOC2H5;G在碱性条件下水解生成乙醇和CH3COONa。
(1)由以上分析知,A为乙烯,其结构简式是CH2=CH2,D为CH3COOH,官能团名称是:羧基。答案为:CH2=CH2;羧基;
(2)在制备CH3COOC2H5的实验中,乙酸与乙醇在浓硫酸、加热条件下发生酯化反应,反应条件是浓硫酸、加热;乙酸乙酯中常混有乙酸和乙醇等杂质,为了除去乙酸乙酯中的杂质,所用的试剂是饱和碳酸钠溶液。答案为:浓硫酸、加热;饱和碳酸钠溶液;
(3)鉴别CH2=CH2和甲烷,可使用的一种试剂是酸性高锰酸钾溶液或溴的四氯化碳溶液。答案为:酸性高锰酸钾溶液或溴的四氯化碳溶液;
(4)①:乙烯与水发生加成反应生成乙醇,化学方程式为CH2=CH2+H2O![]() CH3CH2OH,④:乙酸与乙醇在浓硫酸、加热条件下发生酯化反应生成乙酸乙酯和水,化学方程式为CH3COOH+C2H5OH
CH3CH2OH,④:乙酸与乙醇在浓硫酸、加热条件下发生酯化反应生成乙酸乙酯和水,化学方程式为CH3COOH+C2H5OH![]() CH3COOC2H5+H2O。答案为:CH2=CH2+H2O
CH3COOC2H5+H2O。答案为:CH2=CH2+H2O![]() CH3CH2OH;CH3COOH+C2H5OH
CH3CH2OH;CH3COOH+C2H5OH![]() CH3COOC2H5+H2O。
CH3COOC2H5+H2O。


科目:高中化学 来源: 题型:
【题目】美国芝加哥大学化学研究所近日揭示了WO3/CeO2-TiO2双催化剂在低温下催化氮的污染性气体转化为无毒气体,其过程如图所示
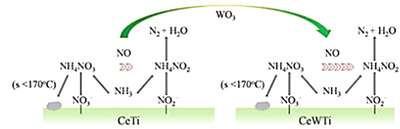
(1)Ti价电子排布式为______________,其能量最高的能层是___________。
(2)N、O、H三种原子的电负性由大到小的顺序为___________________。
(3)NO2-的空间构型为___________,与NO3-互为等电子体的分子为_______________
(4)WO3可作为苯乙烯氧化的催化剂![]() +H2O2
+H2O2![]()
![]() +H2O
+H2O
①![]() 中碳原子的杂化方式为_________。
中碳原子的杂化方式为_________。
②1molH2O2中δ键个数为____________。
③![]() 属于______________晶体。
属于______________晶体。
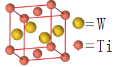
(5)W和Ti可形成金属互化物,某W和Ti的金属互化物如图所示,则该晶体的化学式为__________。
(6)金属钛的晶体堆积方式为 ____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将0.04mol·L-1的某酸(A)溶液和0.02mol·L-1NaOH溶液等体积混合得混合溶液Q。
(1)若A为CH3COOH,Q呈酸性,溶液中所有离子按浓度由大到小排列的顺序是___;若A为HCl,100℃时(Kw=10-12),溶液中由水电离出的H+浓度为___mol·L-1;若A为H2S,Q接近中性,则HS-的电离能力___水解能力(填“>”“<”“=”或“无法确定”)。
(2)根据(1)中信息比较相同条件下,浓度均为0.01mol·L-1的①NaHS、②CH3COONa、③NaCl溶液中,阴离子总浓度由大到小的顺序为___(填序号)。
(3)用浓度为0.01mol·L-1的NaOH溶液滴定相同体积、相同浓度的①HCl溶液、②CH3COOH溶液、③H2S溶液,当滴定至中性时,消耗NaOH溶液的体积分别为amL、bmL、cmL,则a、b、c的大小关系是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程。

下列有关说法正确的是
A.制取NaHCO3的反应是先往精盐溶液中通入CO2,再通入NH3
B.氯碱工业在阳极产生使湿润淀粉碘化钾试纸变蓝的气体
C.可直接加热MgCl2·6H2O制备无水MgCl2
D.在步骤④中,SO2水溶液吸收Br2后,溶液的pH值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:反应①O3![]() O2+[O]ΔH>0平衡常数为K1;反应②[O]+O3
O2+[O]ΔH>0平衡常数为K1;反应②[O]+O3![]() 2O2ΔH<0平衡常数为K2;总反应:2O3
2O2ΔH<0平衡常数为K2;总反应:2O3![]() 3O2ΔH<0衡常数为K。下列叙述正确的是( )
3O2ΔH<0衡常数为K。下列叙述正确的是( )
A.升高温度,K增大B.K=K1+K2
C.适当升温,可提高消毒效率D.压强增大,K2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应aA(g)+bB(g)![]() cC(g),某温度下,在2L密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2L密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
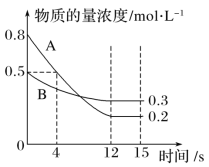
(1)从反应开始到12s时,用A表示的反应速率为___。
(2)经测定,前4s内v(C)=0.05mol·L-1·s-1,则该反应的化学方程式为___。
(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经相同时间后,测量三个容器中的反应速率分别为甲:v(A)=0.3mol·L-1·s-1,乙:v(B)=0.12mol·L-1·s-1,丙:v(C)=9.6mol·L-1·min-1。则甲、乙、丙三个容器中反应速率由快到慢的顺序为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示。
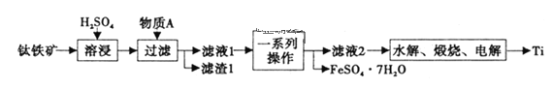
(1)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为___。
(2)物质A为___(填化学式),“一系列操作”为___。
(3)“水解”步骤中生成TiO2·xH2O,为提高TiO2·xH2O的产率,可采取的措施有___、___。(写出两条)。
(4)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式___;若反应后的溶液中c(Fe2+)=2×10-6mol·L-1,则溶液中c(CO32-)=___mol·L-1。(已知:KSP(FeCO3)=2.025×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解,且产生白雾。
(1)SO2Cl2水解的方程式为_______________________________________________
(2)某学习小组的同学依据反应:SO2(g)+ Cl2(g)![]() SO2Cl2(g);△H <0,设计制备磺酰氯装置如图:
SO2Cl2(g);△H <0,设计制备磺酰氯装置如图:
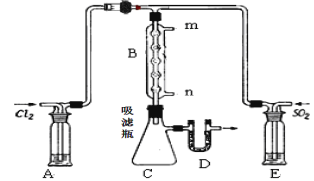
①E中所用的试剂为________________
②实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是____(选填编号);检查该装置气密性的操作是:关闭止水夹,再___________________________________
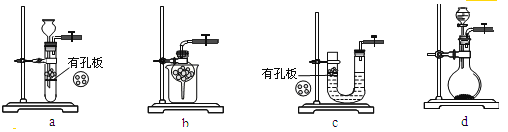
③B处反应管内五球中玻璃棉上的活性炭的作用为:_______________________D处U形管中盛放的试剂为_________________,作用 :________________________
(3)已知:以下三个反应的反应热,a、b、c均为正值
①SO2(g)+Cl2(g)+SCl2(g) ![]() 2SOCl2(g) △H=-akJ·mol-1
2SOCl2(g) △H=-akJ·mol-1
②SO2Cl2(g)+SCl2(g) ![]() 2SOCl2(g) △H=-bkJ·mol-1
2SOCl2(g) △H=-bkJ·mol-1
③SO2Cl2(l) ![]() SO2Cl2(g) △H= + ckJ·mol-1
SO2Cl2(g) △H= + ckJ·mol-1
则反应:SO2(g)+Cl2(g) ![]() SO2Cl2(l) △H=______________kJ·mol-1(用含a、b、c的代数式表示);该反应平衡常数表达式为K=___________。从化学平衡移动角度分析,反应管通水冷却的目的为____
SO2Cl2(l) △H=______________kJ·mol-1(用含a、b、c的代数式表示);该反应平衡常数表达式为K=___________。从化学平衡移动角度分析,反应管通水冷却的目的为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几种有机物:
A.![]() B.
B.![]() C.
C.![]() D.CH2 = CH—CH = CH2E.环戊烷
D.CH2 = CH—CH = CH2E.环戊烷
(1)上述有机物中互为同系物的是_____________,互为同分异构体的是____________。
(2)用系统命名法对B进行命名____________________________________。
(3)A与Cl2反应的类型为_____________;D使溴水褪色的反应类型为___________。
(4)B发生加聚反应的化学方程式为 ____________________________________。
(5)如图表示的是一种叫做双烯合成的有机反应,请写出B与D发生双烯合成所得产物的结构简式__________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com