
����Ŀ������һ����Ҫ�Ľ�������������[��Ҫ�ɷ�Ϊ����������FeTiO3��������������Fe2O3]Ϊԭ���Ʊ��ѵĹ���������ͼ��ʾ��
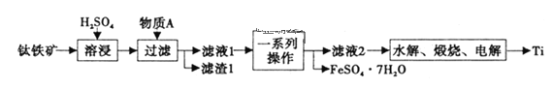
��1����Һ1����Ԫ����TiO2+��ʽ���ڣ����ܽ������̷�������Ҫ��Ӧ�Ļ�ѧ����ʽΪ___��
��2������AΪ___���ѧʽ������һϵ�в�����Ϊ___��
��3����ˮ�⡱����������TiO2��xH2O��Ϊ���TiO2��xH2O�IJ��ʣ��ɲ�ȡ�Ĵ�ʩ��___��___����д����������
��4��������FeSO4��7H2O����ˮ������һ������NaHCO3��Һ�����Ƶ�FeCO3��д����Ӧ�����ӷ���ʽ___������Ӧ�����Һ��c��Fe2+��=2��10-6mol��L-1������Һ��c��CO32-��=___mol��L-1������֪��KSP��FeCO3��=2.025��10-11��
���𰸡�FeTiO3��2H2SO4![]() TiOSO4��FeSO4��2H2O Fe ����Ũ������ȴ�ᾧ������ ��ˮϡ�ͷ�Ӧ�� �Ӽ��к����ɵ��ᡢ���ȵ� Fe2++2HCO3-=FeCO3��+CO2��+H2O 1��10-5
TiOSO4��FeSO4��2H2O Fe ����Ũ������ȴ�ᾧ������ ��ˮϡ�ͷ�Ӧ�� �Ӽ��к����ɵ��ᡢ���ȵ� Fe2++2HCO3-=FeCO3��+CO2��+H2O 1��10-5
��������
�����������ᷴӦ���������Ѻ����������������������ᷴӦ������������ˮ����Һ�к����������ӡ������Ӻ�TiO2+����������ͼ��֪��һϵ�в�������ȡ�����������壬������AΪFe������Һ�е������ӷ�Ӧ�������������ӣ�����������������Ũ�������½ᾧ�õ������������壻TiO2+���Ӿ���ˮ������TiO2��xH2O���پ������ա������ȡTi��
��1���������̿�֪���ܽ�ʱ����Ҫ��ӦΪ�����������ᷴӦ����TiO2+��Fe2+��H2O����Ӧ�ķ���ʽΪFeTiO3��2H2SO4![]() TiOSO4��FeSO4��2H2O��
TiOSO4��FeSO4��2H2O��
��2���������к��������������������ᷴӦ����������ˮ����Ӧ�����������������壬����Ҫ��ȥ��Һ�е������ӣ��Ҳ������µ����ʣ�������AΪ���ۣ���ȡ��Ϊ�����������壬һϵ�в���Ϊ����Ũ������ȴ�ᾧ�����˼�����ȡ�����������壻
��3����Һ�е�TiO2+ˮ�ⷴӦʽΪTiO2++��x+1��H2O=TiO2��xH2O+2H+��Ϊ���TiO2��xH2O�IJ��ʣ����Լ�ˮϡ�ͻ�������ȵȣ�ʹƽ�������ƶ���
��4��FeSO4Ϊǿ�������Σ���Һ�����ԣ�NaHCO3Ϊǿ�������Σ���Һ�Լ��ԣ�����Һ���ʱ����ٽ�ˮ�������̼��������������̼��ˮ����Ӧ�����ӷ���ʽΪFe2++2HCO3-=FeCO3��+CO2��+H2O��KSP��FeCO3��= c��Fe2+����c��CO32-������c��CO32-��= KSP��FeCO3��/ c��Fe2+��=2.025��10-11/2��10-6=1.0125��10-5 mol��L-1��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������(M)��ҽҩ�����ϵ��м��壬ʵ�����ɷ��㻯����A�Ʊ�M��һ�ֺϳ�·�����£�
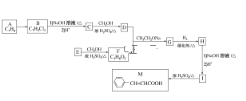
��֪����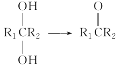 (R1��R2��ʾ��ԭ�ӻ�����)
(R1��R2��ʾ��ԭ�ӻ�����)
��R1COOR2��R3CH2COOR4![]()
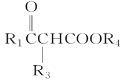 ��R2OH
��R2OH
(R1��R3��ʾ��ԭ�ӻ�������R2��R4��ʾ����)
��ش��������⣺(1)A��B������Ϊ________��
(2)E�����������ŵ�����Ϊ________��
(3)H�Ľṹ��ʽΪ________��(4)I��M�ķ�Ӧ����Ϊ________��
(5)D��F��G�Ļ�ѧ����ʽΪ________________________��
(6)ͬʱ��������������I��ͬ���칹����________��(�����������칹)����дһ�ֺ˴Ź�����������6�����շ��ҷ����֮��Ϊ1��2��2��2��2��1�Ľṹ��ʽΪ_______��
���ܷ�����ɫ��Ӧ��������Ӧ���ڱ�������������ȡ����
(7)��������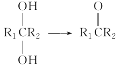 ��Ϣ���Լ���ͱ���Ϊԭ��(�������Լ���ѡ)������Ʊ�
��Ϣ���Լ���ͱ���Ϊԭ��(�������Լ���ѡ)������Ʊ�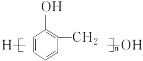 �ĺϳ�·��_______________________��
�ĺϳ�·��_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������ܶ�Ϊ1.25 g/mL����������Ϊ36.5%��Ũ��������240 mL 0.1 mol/L�����ᣬ��ش��������⣺
(1)Ũ��������ʵ���Ũ��Ϊ_________��
(2)���� 240 mL 0.1mol/L�����ᡣ
Ӧ��ȡŨ�������/mL | Ӧѡ������ƿ�Ĺ��/mL |
______ | ______ |
(3)����ʱ������ȷ�IJ���˳����(��ĸ��ʾ��ÿ����ĸֻ����һ�� )_________
A. ��30 mLˮϴ���ձ��ڱںͲ�����23�Σ�ϴ��Һ��ע������ƿ����
B. ����Ͳ��ȷ��ȡ�����Ũ���������������ձ��У��ټ�������ˮ(Լ30 mL)���ò���������������ʹ���Ͼ���
C. ������ȴ�������ز�����ע������ƿ��
D. ������ƿ�ǽ�����ҡ��
E. ���ý�ͷ�ιܼ�ˮ��ʹ��Һ��Һ��ǡ����̶�������
F. ����������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶���12 cm��
(4)��ʵ�������������������������Һ�����ʵ���Ũ���к�Ӱ��(����ƫ��������ƫ��������������)?
������ϡ��������ձ�δϴ��_________��
������ƿ��ԭ����������ˮ_________��
�۶���ʱ�۲�Һ�温��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����273K��101kPa��������,��2.00g����,1.40g������1.60g�������,��
(1)�û������������ʵ���Ϊ______________
(2)�û������������_______________
(3)�û�������ƽ��Ħ������Ϊ_________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ��ԭ�Ӱ뾶��ԭ�������Ĺ�ϵͼ������˵����ȷ���ǣ� ��
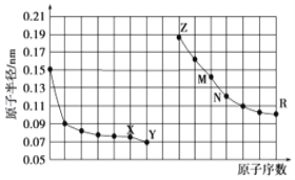
A.M������������Ӧˮ�����ֱܷ���Z��R������������Ӧˮ���ﷴӦ
B.���û�ԭ����ԭR�ļ������Ʊ�R����
C.X��N����Ԫ����ɵĻ������۵�ܵ�
D.�����ӵİ뾶��Z��X��Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�������ܶȻ�������Ksp[Pb��OH��2]=2��10-15��Ksp[Fe��OH��2]=8��10-15������Һ�н�������Ũ��С��10-5molL-1��Ϊ������ȫ����20mL��0.10molL-1Pb2+��0.10molL-1Fe2+�Ļ����Һ�еμ�0.10molL-1NaOH��Һ������������Ũ�������NaOH��Һ����Ĺ�ϵ������ͼ��ʾ��������˵����ȷ���ǣ� ��

A.����A��ʾc(Pb2+)������
B.����ҺpH=8ʱ��Fe2+��ʼ������Pb2+������ȫ
C.����NaOH��Һ�������30mLʱ����Һ��c(Fe2+)=4c(Pb2+)
D.�����£��μ�NaOH��Һ�����У� ��ֵ��������
��ֵ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��������Ԫ�����ڱ���һ����Ԫ�أ��ش��������⣺
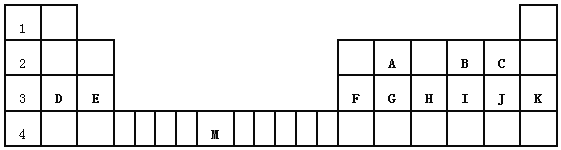
��1����ϡ�����������������ԭ�Ӱ뾶��С����_____����Ԫ�ط��ţ�
��2����������ĸ�����12��Ԫ���У���ѧ��������õ���_____����Ԫ�ط��ű�ʾ����ͬ������������ǿ����___����Ԫ�ط��ű�ʾ�������ڹ���Ԫ�ص���___���ÿո��ñ��е���ĸ��ʾ��
��3��Ԫ��B�ĵ��ʺ��еĻ�ѧ��Ϊ_____�����������Ӽ������������Թ��ۼ��������Ǽ��Թ��ۼ�����
��4��D��FԪ������������Ӧˮ�������Ӧ�����ӷ���ʽΪ_____________
��5��Ϊ�Ƚ�Ԫ��A��G�ķǽ�����ǿ������ͼ��ʾװ�ý���ʵ�飨�г���������ȥ��װ�����������ã�����ҺBӦ��ѡ��_____��Һ��������_________����˵��A��G�ǽ�����ǿ���Ļ�ѧ����ʽ�ǣ�________________________��
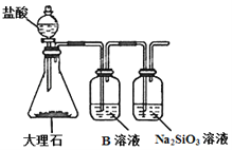
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����VmL0.1mol/L��ˮ�еμӵ����ʵ���Ũ�ȵ�ϡH2SO4����û����Һ���¶Ⱥ�pOH[pOH����lgc(OH��)]���ż���ϡ���������ı仯��ͼ��ʾ(ʵ��Ϊ�¶ȱ仯������ΪpOH�仯)������˵������ȷ���ǣ� ��
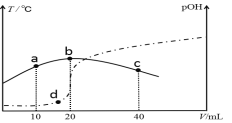
A. a��b��c������ˮ�����c(H+)���μ�С
B. V��40
C. b��ʱ��Һ��pOH>pH
D. a��b��d�����ӦNH3��H2O�ĵ��볣����K(b)>K(d)>K(a)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� 1molCO�� 2molH2����һ�ݻ�Ϊ 1L���ܱ������У��ֱ���250��C��T��C�·�����Ӧ��CO(g)+2H2(g) ![]() CH3OH(g)������ͼ�����з�������ȷ���ǣ� ��
CH3OH(g)������ͼ�����з�������ȷ���ǣ� ��
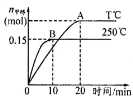
A. 250��Cʱ����Ӧ��ǰ10s��ƽ��������(H2)=0.015mol/(L��min)
B. ƽ��ʱCO��ת���ʣ�250��C��T��C
C. ��Ӧ��ƽ��������������䣬����С�ݻ������CO �����������
D. �÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com